下列对沉淀溶解平衡的描述正确的是
| A.反应开始时,溶液中各离子浓度相等 |
| B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
| C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
D.沉淀溶解达到平衡时,如果再 加入难溶性的该沉淀物,将促进溶解 加入难溶性的该沉淀物,将促进溶解 |
下列叙述正确的是
| A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| B.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl) |
| C.25℃时,pH=4,浓度均为0.1mol·L—1的CH3COOH、CH3COONa混合溶液: c(CH3COO—)+c(OH—)>c(CH3COOH)+c(H+) |
| D.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: c(Na+)=c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
100 mL KNO3和Cu(NO3)2的混合溶液中c(NO3—)=6.0 mol/L,用石墨作电极电解此溶液,通电一段时间后,两极均收集到4.48 L气体(标准状况),假定电解后溶液体积仍为100 mL,下列说法不正确的是
| A.原混合溶液中c(K+)=1 mol/L |
| B.上述电解过程中一共转移电子0.8 mol |
| C.电解得到的铜的物质的量为0.2 mol |
| D.电解后溶液中c(H+)=2 mol/L |
取一张用饱和NaCl溶液浸泡的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误的是
| A.M是直流电的正极 |
| B.电子流向是N→b→a→M |
| C.电解过程中,水是氧化剂 |
| D.b电极附近溶液的pH变小 |
下列叙述的实验能达到预期目的的是:
| 实验内容 |
实验目的 |
|
| A |
在稀AgNO3溶液中加入少量NaCl溶液产生白色沉淀后再加入适量NaI溶液,出现黄色沉淀 |
说明Ksp(AgCl)>Ksp(AgI) |
| B |
分别向2支试管中加入等体积等浓度的Na2S2O3溶液,再向其中分别加入等体积不同浓度的H2SO4溶液 |
研究反应物浓度对化学反应速率的影响 |
| C |
向混有亚硫酸钠的硫酸钠溶液中加入适量的BaCl2溶液 |
检验SO42-存在 |
| D |
向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液 |
制备Fe(OH)3胶体 |
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下: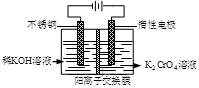
下列说法不正确的是
| A.在阴极室,发生的电极反应为:2H2O+2e—=2OH—+H2↑ |
| B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡 2CrO42—+2H+  Cr2O72—+H2O向右移动 Cr2O72—+H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr )为d,则此时铬酸钾的转化率为1- |