固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g) + 3H2(g) CH3OH(g) +H2O(g) △H="-49.0" kJ·mol-1。
CH3OH(g) +H2O(g) △H="-49.0" kJ·mol-1。
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)
回答下列问题:
(1)该反应在0~8 min内CO2的平均反应速率是 mol/(L?min)。
(2)该反应的平衡常数K= 。
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 。若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的
| A.化学反应速率理论可指导怎样在一定时间内快出产品 |
| B.有效碰撞理论可指导怎样提高原料的转化率 |
| C.勒夏特列原理可指导怎样使用有限原料多出产品 |
| D.催化剂的使用是提高产率的有效方法 |
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
某化学小组采用如图装置,以冰醋酸和异戊醇制备少量乙酸异戊酯(俗称:香蕉水)。
已知:CH3COOH+HOCH2CH2CH(CH3)2 CH3COOCH2CH2CH(CH3)2+H2O
CH3COOCH2CH2CH(CH3)2+H2O
密度(g/m L) L) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 冰醋酸 |
1.049 |
16.6 |
118.1 |
能溶于水 |
| 异戊醇 |
0.812 |
-117.2℃ |
130.5 |
微溶于水 |
| 乙酸异戊酯 |
0.869 |
-78℃ |
140 |
难溶于水 |
实验步骤:
(1)制备粗品
在50mL干燥的中(填仪器名称)加入10mL(8.1g , 0.092mol)异戊醇和10mL(10.5g , 0.175mol)冰醋酸,振摇下缓缓加入2.5mL浓硫酸并使其混合均匀,再投入几块碎瓷片,装上冷凝管,冷却水从_________口进入,控制温度100℃左右,加热回流至锥形瓶中液体无明显增加为止。
A中碎瓷片的作用是
锥形瓶中的液体主要是,采用边反应边将其蒸出的方法的目的是。
(2)制备精品
①反应结束后,冷却反应物至室温。将装置A中的反应混合物倒入分液漏斗中,用少量饱和食盐水荡洗反应瓶,一起并入分液漏斗。用饱和食盐水代替蒸馏水的优点是。
②振摇分液漏斗,静置分层后分去水层。有机层先用25 mL 10% 碳酸钠水溶液洗涤除去杂质 ,再用水洗涤两次。分尽水层后将酯层转入干燥的锥形瓶中,用(填写选项)干燥0.5h。
a.五氧化二磷 b.碱石灰 c.无水硫酸镁 d.生石灰
③将干燥后的液体过滤到装置A中,加热蒸馏收集℃的馏分,称重,产物重8.4g,则该实验的产率为。(保留两位有效数字)
 是周期表中原子序数依次增大的前20号元素。
是周期表中原子序数依次增大的前20号元素。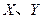 同周期。
同周期。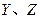 同主族,Zn-与
同主族,Zn-与 离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下
离子的电子层结构相同。由这四种元素形成的单质、化合物有如下图转化关系。已知:常温下 为液体,
为液体, 为气态化合物,且
为气态化合物,且 均为直线型分子;
均为直线型分子; 是由元素
是由元素 形成的常见化合物。
形成的常见化合物。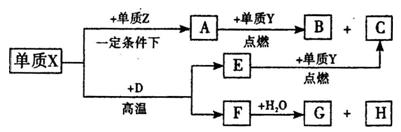
(1)元素 的名称,
的名称, 的电子式,F晶体中含有的化学键类型。
的电子式,F晶体中含有的化学键类型。
(2)写出 的化学式:
的化学式: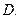 、
、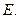 。
。
(3)①已知38g 与单质
与单质 完全反应生成
完全反应生成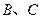 时放出
时放出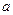 kJ的热量,写出该反应的热化学方程式:
kJ的热量,写出该反应的热化学方程式:
②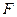 与水反应的化学方程式:
与水反应的化学方程式:
已知甲、乙、丙、丁、戊为纯净物,它们之间有如下转化关系。请填空:
(1)若甲为厨房中常见的调味品,在熔融条件下电解能实现上述转化。以惰性电极电解甲的水溶液时,电解反应的离子方程式为:。
(2)若甲为常见的离子化合物,可用作化肥,在加热条件下能实现上述转化。则反应②的化学反应方程式:。实验室测定丁的相对分子质量时,得到的实验值总是比理论值大,其原因是。(用方程式表示)
(3)若甲为制镜工业的常用物质,相对分子质量是甲醛的6倍,在催化剂存在条件下能实现上述转化。则反应①的化学反应方程式为:;以 乙物质为燃料的微生物燃料电池结构示意图如图所示,该原电[来池的负极反应方程式为
乙物质为燃料的微生物燃料电池结构示意图如图所示,该原电[来池的负极反应方程式为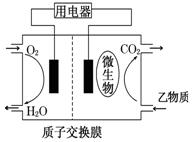
(6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池。
(1)画出装置图(在图中标出电极材料、正负极、电解质溶液)。
(2)写出电极反应方程式
负极 :
:
正极:(各2分)
(5分)我国经济发展对能源的需求与日俱增。一种新型燃料电池是将两根特制电极插入氢氧化钾溶液中,然后从两极分别通入甲烷和氧气,其电极反应式为:
X极:CH4+10OH- -8e- ="=" CO32-+7H2O Y极:4H2O+2O2+8e- ==8OH-
( 1)、指出该电池的正极__________(X极或Y极)(1 分)
分)
(2)、在标准状况下,通入5.6L甲烷气体,完全反应后有__________mol电子转移;
(3)、该电池的电解质溶液的PH变化是__________(填升高、降低、不变)(2分)