硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________(填编号)。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
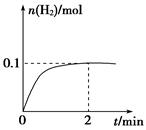
①0~2 min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g) 
2HI(g)的平衡常数K= 。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的 能量转化率为________。
能量转化率为________。
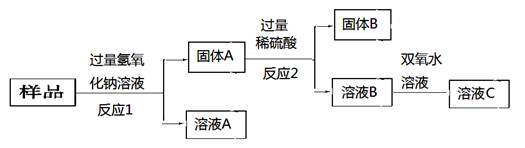
由Fe、CuO、C、Al组成的混合粉末,取样品进行下列实验(部分产物略去):
(1)反应1中的化学方程式是:;
(2)反应2中的离子方程式是:。
(3)当溶液B变成溶液C时双氧水变成了水,请完成该反应的离子方程式:
(配平的化学计量数写在方框内,若计量数为“1”也要写出来)□ Fe2++ □ H2O2+ □ H+ = □ Fe3++ □ H2O
此该反应的还原剂为。
(4)已知固体B与浓硫酸共热可以产生两种气体,若反应后硫酸变成SO2,则1.5mol硫酸完全反应转移的电子数为mol。
(1)把暴露在空气中一段时间的金属钠分为两份:一份投入足量水中;另一份放在坩埚中灼烧,再把灼烧后坩埚里的固体物质投入到足量的水中。请分析整个过程中可能发生的化学反应,并按下列要求填写。
①若是非离子反应的请写出化学方程式
②若是离子反应的请写出离子方程式
(2)钙和氢气在一定温度下可化合生成一种灰白色的化合物A,A是一种金属氢化物。取少量A投入水中,剧烈反应并产生一种无色无味易燃气体,同时形成一种碱溶液。请写出化合物A与水反应的化学方程式,并用单线桥标出该反应中电子转移的情况:。
(18分)某化学学习小组用某种粗盐进行提纯实验,步骤如下图所示:
已知粗盐中含有的杂质离子主要为:K+、Mg2+、Ca2+、Fe3+、SO42-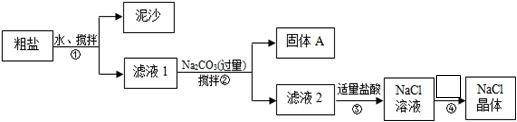
(1)步骤①和②的操作名称是,所需要玻璃仪器为
(2)步骤②中在加入Na2CO3溶液之前还需加入过量NaOH溶液和BaCl2溶液
固体A是:、BaCO3。(用化学式表示)
请写出步骤②中加入NaOH溶液所发生的离子反应(用离子方程式表示):
(3)步骤②中检验SO42-沉淀完全的操作是:
(4)步骤③中加入盐酸的作用是(用离子方程式表示)
(5)步骤④的操作为:、过滤;其中第一步操作所需仪器有:三脚架、玻璃棒、。
(16分)有一固体混合物,可能由K2CO3、Na2SO4、CuSO4、BaCl2、NaCl等其中的一种或几种混合而成。为检验它的成分,做了如下实验:
①将混合物加水溶解,搅拌后得无色澄清溶液。
②往此溶液中滴加足量硝酸钡溶液,有白色沉淀生成。
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀完全不溶解。试判断:
(1)固体混合物中肯定有,肯定没有,可能有。(均填化学式)
(2)对可能有的物质,如要检验其是否存在,将如何操作?______ ________________
(3)写出②③发生的有关反应的离子方程式:②
③____________________________________________ _______________ _____
(4)工业上常用电解氯化钠溶液的方法制Cl2,其化学方程式为: 2NaCl + 2H2O 通电 2NaOH + H2↑ + Cl2↑,用单线桥法表示该反应电子转移情况。
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol.
2SO3(g)反应过程的能量变化如图所示.已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol.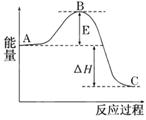
请回答下列问题:
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________.该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是
(2) 图中反应是(填“吸热”或“放热”)反应,该反应(填“需要”或“不需要”)提供能量。
(3)如果反应速率v(SO2)为0.05 mol/(L·min),
则v(O2)=__________mol/(L·min)、v(SO3)=________ mol/(L·min).
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程).