在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向溶液中加入溴水,溴单质被还原,由此可推断溶液中
| A.一定含有I-,不含有Cl- | B.可能含有Cl-、NO3-和I- |
| C.可能含有NO3- | D.一定不含有Fe3+ |
对于反应A(g)+3B(g) 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)="0.04" mol·L-1·s-1 B.v(B)="0.03" mol·L-1·s-1
C.v(C)="0.04" mol·L-1·s-1 D.v(C)="0.06" mol·L-1·s-1
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 |
1.92gCu投入一定量的浓HNO3溶液中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积(标况)为
| A.168 mL | B.504 mL | C.336 mL | D.448 mL |
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应: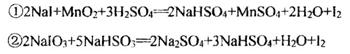
下列说法正确的是
| A.两个反应中NaHSO4均为氧化产物 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
C.氧化性:MnO2>SO >IO >IO >I2 >I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1:5 |
下列关于某溶液所含离子检验的方法和结论正确的是
| A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+ |
B.通入少量Cl2后,溶液变为黄色,再加入淀粉溶液后,溶液变蓝,说明有I |
C.加入盐酸产生能使澄清灰水变浑浊的气体,原溶液中一定有CO3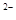 或SO 或SO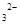 |
D.往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO |