(12分)科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。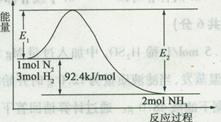
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的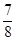 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H="+1530" kJ/mol
H="+1530" kJ/mol
又知:H2O(1)=H2O(g)  H=+44.0 kJ/mol
H=+44.0 kJ/mol
则2N2(g)+6H20(g) 4NH3(g)+302(g)
4NH3(g)+302(g)  H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:
CO(g)+2H2(g) CH3OH(g);△H
CH3OH(g);△H
下图表示某次合成实验过程中甲醇的体积分数 φ(CH3OH)与反应温度的关系曲线,若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K1 (填“>、< 或 = ”)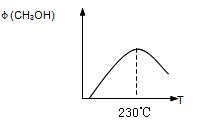
(2)利用甲醇燃料电池设计如下图所示的装置:则该装置中Cu极为极;写出b极的电极反应式 ,当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。
L。 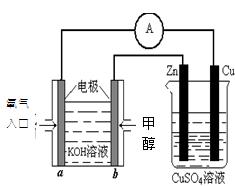
| 难(微)溶物 |
溶度积常数(Ksp) |
BaSO 4 4 |
1×10-10 |
| BaCO3 |
2.6×10-9 |
| CaSO4 |
7×10-5 |
| CaCO3 |
5×10-9 |
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。
具体做法是用饱和纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥
 mol·L-1
mol·L-1
某实验室把学生做完实验后的废液(含氯化钠、氯化铁、氯化铜等)进行集中处理,过程如下: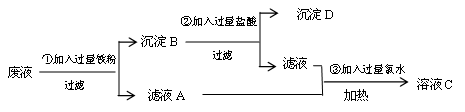
(1)沉淀D的化学式为。
(2)反应③中Cl2属于(填“氧化剂”或“还原剂”)。
(3)写出①反应中的离子方程式
。
(4)溶液C中的溶质是(提示:加热后,溶液中没有了HCl和Cl2),若要进一步进行分离,方法是。
A、B、C、D四种化合物的焰色反应均为黄色;C、D与盐酸生成一种无色无味气体E,该气体能使澄清石灰水变浑浊;D和A可反应生成C;B和E反应可生成C和另一种无色无味气体F。请回答下列问题:
(1)写出E、F的化学式:E,F。
(2)写出B和E反应的化学方程式:。
(3)写出D和A反应的离子方程式:。
铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了。
(3)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示)。
(4)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为。
下列两组混合物,括号内为杂质,填写除去杂质所需试剂或方法,并写出反应的化学方程式。(请按相应序号填在答题卷上)
| 混合物 |
试剂或方法 |
化学方程式 |
| Na2CO3固体(NaHCO3) |
① |
② |
| Fe2O3粉末(Al2O3) |
③ |
④ |