现有金属单质A.B.C和气体甲、乙、丙及物质D.E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。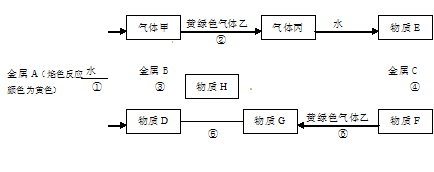
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A 、 B 、 C 、 F 、 H 、 乙
(2)写出下列反应化学方程式:
反应①
反应⑤
反应⑥
(6分)按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
(1)A, B两个装置中,属于原电池的是(填标号,下同)。
(2)B池中,右边C是极,电极反应式为:;
(3)A池中溶解了6.5g锌时,转移了mol电子。
Ⅰ、碳是地球上含量丰富的元素,其氧化物的研究有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式_______________;
(2)试在原图基础上画出加入正催化剂后该反应在反应过程中的能量变化示意图(进行必要的标注)。
Ⅱ、全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。
全钒液流电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子【V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)】为正极和负极电极反应的活性物质
电池总反应为VO2++V3++H2O V2++VO2++2H+。
V2++VO2++2H+。
下图是钒电池基本工作原理示意图:
请回答下列问题:
(1)放电时的正极反应式为____
(2)充电时的阴极反应式为_________________,
充电过程中,电解液的pH(选填“升高”“降低”或“不变”)。
(3)放电过程中氢离子的作用是______;
若充电时转移电子的数目为6.02×1023,则左槽溶液中H+的变化量为mol 。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,
该反应的化学方程式为:________________________________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+ CO(g) CH3OH(g); ΔH = -90.8 kJ·mol-1
CH3OH(g); ΔH = -90.8 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g); ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g); ΔH= -23.5 kJ·mol-1
③CO(g)+ H2O(g) CO2(g)+ H2(g); ΔH= -41.3 kJ·mol-1
CO2(g)+ H2(g); ΔH= -41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2 (g)的ΔH= ___________;
CH3OCH3(g)+ CO2 (g)的ΔH= ___________;
若总反应平衡后,要提高CO的转化率,可以采取的措施是___(填字母代号)
a.升温
b.加催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(3)已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下平衡常数为400 。
CH3OCH3(g)+ H2O(g)某温度下平衡常数为400 。
此温度下,某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol/L) |
0.85 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正______ v逆 (填“>”、“<”或“=”)。
②若从此刻又经过10 min达到平衡, 则这段时间内反应速率v(CH3OH)= ________ 。
(8分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
请回答下列问题:
(1)甲池为(填“原电池”、“电解池”或 “电镀池”),A电极的电极反应式为。
(2)丙池中F电极为(填“正极”、“负极”、“阴极”或“阳极”),
该池的总反应方程式为。
(3)当池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为mL(标准状况)。
(4)一段时间后,断开电键K,加入下列物质能使丙池恢复到反应前浓度的是(填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
完成下列化学用语的书写:
(1)用离子方程式表示碳酸钠溶液显碱性的原因:___________________。
(2)实验室配制的CuSO4溶液,常常出现浑浊的原因是
(写离子方程式),可采取在配制时加入少量防止出现浑浊。
(3)泡沫灭火器中盛放的灭火剂包括Al2(SO4)3溶液(约1 mol/L)、NaHCO3溶液(约1 mol/L)及起泡剂。使用时发生反应的离子方程式是________________________________
(4)已知断裂1 mol H2(g)中的H—H键需要吸收436kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O键能放出463kJ的能量。试写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式:。