韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成 “暖冰”。下列关于“暖冰”的说法不正确的是( )
| A.“暖冰”也是水分子间通过氢键结合而成的固体 |
| B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化 |
| C.形成20℃时的“暖冰”的变化是物理变化 |
| D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰 |
下列关于有机化合物的结构、性质说法正确的是
| A.在铁存在下,苯与溴水发生取代反应生成溴苯 |
| B.用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 |
| C.正丁烷和异丁烷互为同分异构体,它们分子中所含化学键种类和数量不完全相同 |
| D.在一定条件下,乙烯能与H2发生加成反应,苯不能与H2发生加成反应 |
下列有关物质应用的说法正确的是
| A.明矾常用于自来水的净化、杀菌消毒 |
| B.“玉兔”月球车太阳能电池帆板的材料是二氧化硅 |
| C.氧化铁常用作红色油漆和涂料 |
| D.碳酸钠可用于治疗胃酸过多 |
在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是
A.2NO(g)+O2 (g)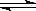 2NO2 (g) 2NO2 (g) |
B.Br2(g)+H2 (g)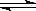 2HBr (g) 2HBr (g) |
C.N2O4(g)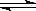 2NO2 (g) 2NO2 (g) |
D.6NO(g)+4NH3 (g)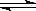 5N2(g)+3H2O(g) 5N2(g)+3H2O(g) |
在a、b、c、d四个不同的容器中,在不同条件下进行3H2 + N2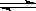 2NH3反应。在时间t时测得:a容器中V(N2)=" 0.5" mol/(L・min) ,b容器中V(H2)=" 1.2" mol/(L・min),c容器中V(NH3)=" 0.4" mol/(L・s), d容器中V(NH3)=" 1.1" mol/(L・min)则在时间t时,反应速率最大的是
2NH3反应。在时间t时测得:a容器中V(N2)=" 0.5" mol/(L・min) ,b容器中V(H2)=" 1.2" mol/(L・min),c容器中V(NH3)=" 0.4" mol/(L・s), d容器中V(NH3)=" 1.1" mol/(L・min)则在时间t时,反应速率最大的是
| A.a容器中 | B.b容器中 | C.c容器中 | D.d容器中 |
t℃时水的离子积常数为1.0×10-12,t℃下列叙述正确的是
| A.pH为7 的溶液呈中性 |
| B.0.01mol/L氢氧化钠溶液的pH为12 |
| C.0.01mol/L盐酸的pH为2 |
| D.t℃时水的电离程度比常温时水的电离程度小 |