(6分)氨气跟氧化铜反应可以制备氮气,化学方程式:2NH3+3CuO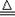 3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
| A.NH4Cl固体与消石灰(Ca(OH)2)共热 | B.浓氨水逐滴加到新制的生石灰中 |
| C.在一定条件下,N2与H2化合 | D.加热分解NH4Cl固体 |
你认为其中合理的方案有 (填字母);其反应的化学方程式为: ; 。
(10分)神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验。火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为:S+3C+2KNO3=K2S+N2↑+3CO2↑。
①K2S的电子式为。
②取黑火药爆炸后的残留固体,加水溶解过滤,得到滤液。写出检验此溶液中是否含有K+的实验操作方法。
(2)20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有肼(N2H4)、液氢等。
①肼(N2 H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:。
②一种与N2 H4电子数相等的绿色氧化剂,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,化学方程式为:。
(3)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富。有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。写出其爆炸的化学方程式。
(1)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O。当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为。
(2)氨气的制备与运输过程中都有严格要求。运输时,严禁与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,若0.4 mol NH3参加反应时有0.3 mol 电子转移,写出反应的化学方程式____。
[化学—选修5:有机化学基础](15分)
高分子材料PET聚酯树脂和PMMA的合成路线如下:
已知:Ⅰ.RCOOR′+ R′′18OH 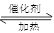 RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
|
Ⅱ.(R、R′代表烃基)
(1)①的反应类型是________。 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
[化学—选修3:物质结构与性质](15分)
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为________(填元素符号),其原因为______。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
[化学—选修2:化学与技术](15分)
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O—NaBr + NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为mol。
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为,产品2的化学式为,1L浓海水最多可得到产品2的质量为g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式。