常温下,将0.02molKOH和0.1molNH4Cl溶于水配成1L溶液,
(1)用离子方程式表示该溶液中存在的三个平衡体系:______、_____、______。
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0. 1mol/L的是 (填元素符号),
浓度为0.02mol/L的是 (填元素符号)。
(4)物质的量之和为0.1mol的二种粒子是______ (填元素符号)。
(6分)已知离子反应:RO+6I-+6H+===R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒”等判断:n=______________,R元素在RO3-中的化合价是______________。
某溶液中可能含有大量下列阴离子:OH-、SO、CO、Cl-。
(1)当溶液中存在大量H+时,则溶液中不可能有________________。
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有________________。
(16分)Ⅰ铝粉与某些金属氧化物组成的混合物叫铝热 剂,铝热剂在高温下发生的反应叫铝热反应。如:2Al+
剂,铝热剂在高温下发生的反应叫铝热反应。如:2Al+ Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上
Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上 述信息回答下列问题:
述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的________________反应。
(2)信息中的“某些”指__(填“比铝活泼的”“比铝不活泼的”或“任意”)。
(3)试写出铝粉与MnO2发生的铝热反应方程式
_____________________________________________________________。
(4)题给的铝热反应可用于野外焊接钢轨,试解释其基本原理________________________________________________________________。
II铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途。
(5)铝制容器不能盛装NaOH溶液的原因(用离子方程式表示)
; (6)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示): ;
(6)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示): ;
碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式:
;
(7)为完全沉淀氯化铝溶液中的铝元素,常加入过量的 ,反应的化学方程式: 。
已知有机物A分子由C、H、O三种元素组成,其相对分子质量为120,0.1 molA在足量的氧气中充分燃烧后生成0.8mol CO2和7.2g H2O;A可以发生银镜反应,其苯环上的一卤代物有三种。
molA在足量的氧气中充分燃烧后生成0.8mol CO2和7.2g H2O;A可以发生银镜反应,其苯环上的一卤代物有三种。
(1)A的分子式是,A中含氧官能团的名称是,A的结构简式为。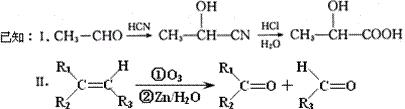
现有如下转化关系: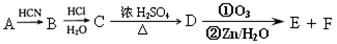
其中D能使溴的四氯化碳溶液褪色,F继续被氧化生成G,G的相对分子质量为90。
(2)C可能具有的化学性质有(填序号)。
①能与H2发生加成反应;②能在碱性溶液中发生水解反应;③能与甲酸发生酯化反应;④能与Ag(NH3) 2OH溶液发生银镜反应;⑤能与氢氧化钠溶液反应
(A)①②③(B)①③⑤(C)①②③⑤(D)②③④⑤
(3)①写出C→D的化学反应方程式;反应类型为;
②在催化剂条件下,C生成高聚物的化学方程式;
③ G与足量NaHCO3溶液反应的化学方程式。
(4)C的同分异构体有 多种,其中符合下列要求的有机物有两种:
多种,其中符合下列要求的有机物有两种:
①属于酯类化合物;②遇三氯化铁溶液显紫色;③与新制氢氧化铜悬浊液共热可生成红色沉淀;④苯环上的一卤代物只有一种
写出其中一种有机物的结构简式。
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)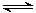 CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
①该反应的化学平衡常数的表达式K =,由上表数据可得,该反应为反应。(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)="0.01" mol·L-1、c(H2O)="0.03" mol·L-1、c(CO2)="0.01" mol·L-1、c(H2)="0.05" mol·L-1,则反应开始时,H2O的消耗速率比生成速率(填"大"、"小" 或"不能确定")
或"不能确定")
③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)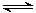 CH3OH(g)+H2O
CH3OH(g)+H2O (g)△H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
(g)△H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示: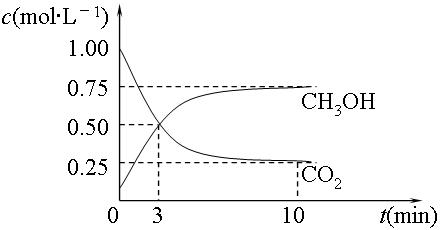
①平衡时CH3OH的体积分数w为。
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数 据如下。下列说法正确的是
据如下。下列说法正确的是
| 容器 |
实验1 |
实验2 |
实验3 |
| 反应物投入量(始态) |
1mol CO2、3mol H2 |
1mol CH3OH、1mol H2O |
2mol CH3OH、2mol H2O |
| CH3OH的平衡浓度/mol·L-1 |
C1 |
C2 |
C3 |
| 反应的能量变化 |
放出 x kJ |
吸收y kJ |
吸收z kJ |
| 体系压强/Pa |
P1 |
P2 |
P3 |
| 反应物转化率 |
a1 |
a2 |
a3 |
A.2 C1>C3 B.x+y="49.0" C.2P2< P3
D.(a1+ a3)<1 E.2P1> P3 F.a1= a2
③在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g)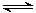 CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小。
CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小。