(12分)
(1)以甲烷、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池。该电池的负极反应式为 。
(2)用如图所示装置进行电解①若A、B均为石墨电极,C为足量CuS04溶液,则电解的总反应方程式为 。
电解一段时间后,取出电极,向电解液中加入适量的 (填化学式)可使C溶液恢复到电解前的成分和浓度。
②若A、B均为铂电极,C为Na2SO4溶液(含酚酞),电解一段时间后, (填“A”或“B”)极附近显红色;将电极取出,搅拌使溶液混合均匀,测得溶液的pH 7(填“<”、“=”或“>”)。
③若A、B为同一材料的电极,C为CuCl2溶液,电解过程中CuCl2溶液的浓度始终 保持不变,则A、B为 (填化学式)电极;当电路中有0.04 mol电子通过时,阴极增重( ) g。
亚氯酸钠(NaC1O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖,油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: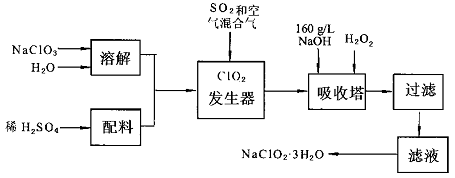
已知:①NaC1O2的溶解度随温度升高而增大,适当条件下可结晶析出NaC1O2·3H2O.
②纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
I.请根据上述流程回答下列问题
(1)发生器中鼓入空气的作用可能是
(2)吸收塔内的反应的化学方程式为.吸收塔的温度不能超过20℃,其目的是.
(3)在碱性溶液中NaC1O2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是.
(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是.
II.上述流程中的原料NaC1O3可由氯气通入热的烧碱溶液后重结晶就得到比较纯净的产品,所以通常工厂联合氯碱车间制备.
(1)氯碱工业中的原料为,原料需要净化的原因是,阳极产品为
(2)工业生产NaC1O3的化学方程式为
甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
反应II: CO2(g)+3H2(g) CH3OH(g)+ H2O(g)ΔH2
CH3OH(g)+ H2O(g)ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②在其他条件不变得情况下,考察温度对反应II的影响,实验结果如图所示
由图中数据判断ΔH20 (填“>”,“=”或“<”).
③某温度下,将2 mol CO2和6 mol H2充入2L的密闭容器中,发生反应II,达到平衡后,测得c(CO2)= 0.2 mol/L,则此时容器中的压强为原来的倍
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池负极的电极反应为
②此电池消耗甲醇1.6克时,反应中电子转移数目为
③若以此燃料电池为铅蓄电池充电,则应将图中右侧电极连接蓄电池的(填正极或负极)
X,Y,Z,Q,R是五种短周期元素,原子序数依次增大.X,Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z,R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)上述元素原子半径由大到小的顺序是(写元素符号)
(2)X,Y,Z能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写名称)
该物质能使酸性高锰酸钾溶液褪色同时生成一种生活中常见有机物,此过程的离子方程式为
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系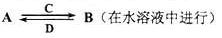
其中C是溶于水显酸性的气体;D是淡黄色固体.
写出C的结构式;
①如果A,B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式
②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性.用离子方程式表示A溶液显碱性的原因. A,B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下: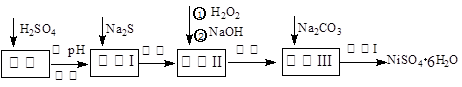
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,是因为: _____ ________。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值3~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:___________________________________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。(填化学式)
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解,,洗涤获得产品。
某同学设计如图装置,研究非金属元素性质变化规律.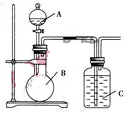
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl=NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性。现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3。
A中装试剂________,B中装试剂____________,C中装试剂____________。C中实验现象为____________;写出C中发生反应的离子方程式_____________________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂________,C中现象________,写出离子方程式__________________。该实验装置有明显不足,请指出改进方法:_______________________________________。
(3)如果C中装饱和的氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,写出化学方程式______________________________;证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”)。