NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下: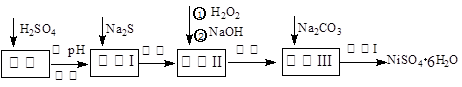
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,是因为: _____ ________ 。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值3~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:___________________________________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。(填化学式)
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解, ,洗涤获得产品。
异丙苯(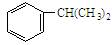 )是一种重要的有机原料。根据题意完成下列填空:
)是一种重要的有机原料。根据题意完成下列填空:
(1)由苯与2-丙醇反应制备异丙苯属于反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为。
(2)异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的名称是。
(3)α-甲基苯乙烯(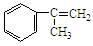 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(已知侧链中与苯环相连的第一个碳原子上C—H最容易断裂,发生取代反应。用化学反应方程式表示此多步过程)。
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(已知侧链中与苯环相连的第一个碳原子上C—H最容易断裂,发生取代反应。用化学反应方程式表示此多步过程)。
(4)耐热型ABS高分子树脂由丙烯腈(CH2=CHCN)、1,3-丁二烯和α-基苯乙烯共聚生成,假设各单体等物质的量聚合,写出该树脂的结构简式。
一个国家乙烯工业的发展水平,已成为衡量该国石油化学工业水平的重要标志之一。以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。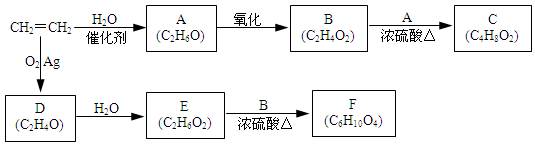
已知:①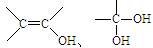 结构非常不稳定,会迅速转变为
结构非常不稳定,会迅速转变为
②三元环状化合物易发生开环加成,例如:
请回答下列问题:
(1)A的化学名称是_______。
(2)B和A反应生成C的化学方程式为___________。
(3)D的结构简式为___________。
(4)F的结构简式为_____________。
(5)D的同分异构体的结构简式为___________。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题: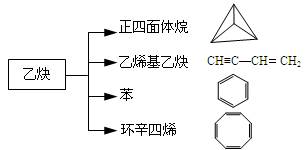
(1)正四面体烷的二氯取代产物有种。
(2)关于乙烯基乙炔分子的说法错误的是
a、能使酸性高锰酸钾溶液褪色
b、1mol乙烯基乙炔能与3mol Br2发生加成反应
c、乙烯基乙炔分子内含有两种官能团
d、等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):、。
生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。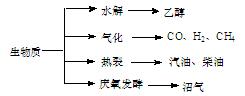
(1)下列有关说法正确的是。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应: CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
| 平衡常数 |
K1 |
K2 |
K3 |
| 反应物转化率 |
α1 |
α 2 |
α3 |
下列说法正确的是。
a. c1=c2 b. 2Q1=Q3 c. K1=K3 d. α2+ α3<100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)=mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。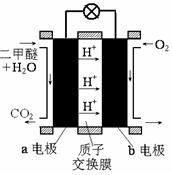
b电极是极;a电极的反应式为。
( 12分)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。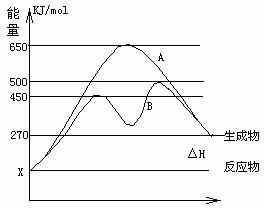
(1)据图判断该反应是___①___(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__②__ (填“增大”、“减小”或“不变”)
(2)其中B历程表明此反应采用的条件为___③___ (选填下列序号字母),作出正确的判断的理由为__④____
A、升高温度 B、增大反应物的浓度C、降低温度 D、使用了催化剂
(3)若△H的数值为200KJ/mol,则此反应在A反应历程中的正反应的
活化能为___⑤___KJ/mol,x值应为 ___⑥___KJ/mol.