(10分)利用催化剂可使NO和CO发生反应:2NO(g)+2C0(g) 2CO2(g)+N2(g) △H<0。
2CO2(g)+N2(g) △H<0。
已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(1)请填全表中的各空格;
(2)实验I中,NO的物质的量浓度(c)随时问(t)的变化如下图所示。请在给出的坐 标图中画出实验Ⅱ、III中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: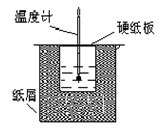
(1)从实验装置上看,图中伤缺少的一种玻璃仪器是_____________;
(2)烧杯间填满碎纸条的作用是____________________;
(3)若大烧杯上不盖硬纸板,求得的反应热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60 mL 0.50 mol·L-1HCl跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”)。
工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O==NH4HCO3,NH4HCO3+NaCl(饱和)==NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟实验这一过程,获得碳酸钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器旁自左至右分别用A、B、C……符号标明(请见题后说明)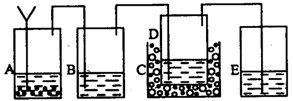
(1)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
A:__________________,B:___________________,C:__________________,
D:__________________,E_____________________。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶?
实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参加反应)。请回答下列问题: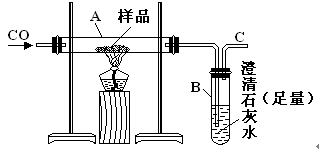
(1)该实验中炼铁的方法是填字母)。
| A.热分解法 | B.热还原法 | C.电解法 | D.湿法冶金 |
(2)实验开始后,B中的现象是。
A中有关反应的化学方程是。
(3)C处须进行尾气处理,其方法是。
(4)若样品的质量为3.6g,通入足量的CO充分反应后,B增重2.64g,则样品中铁的质量分数为(结果保留一位小数)。
海带中含有丰富的碘元素,某化学研究性学习小组用如下流程从海水中提取碘: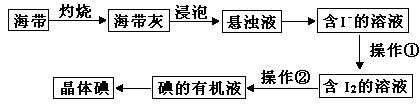
(1)若操作①为通入适量的Cl2,则发生反应的离子方程式为。
(2)操作②的名称是,所用的玻璃仪器有,可以选用的有机溶剂是(填一种)。
将下图所列仪器组装成一套实验室蒸馏石油的装置,并进行蒸馏得到汽油和煤油。
| (三) |
(一) |
(五) |
(二) |
(六) |
(四) |
 |
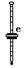 |
 |
 |
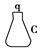 |
 |
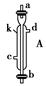
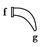
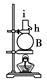
(1)上图中A、B、C三种仪器的名称是________。
(2)将以上仪器(一)→(六),按连接顺序表示(用字母a,b,c……表示):
e接i;________接________;k接l;________接________;________接________。
(3)A仪器中,c口用于________,d口用于________。
(4)蒸馏时,温度计水银球应在________位置。
(5)在B中注入原油后,再加几片碎瓷片的目的是________。
(6)给B加热,收集到沸点在60~150 ℃之间的馏分是________,收集到150~300 ℃之间的馏分是________。