下图是工业生产硝酸铵的流程。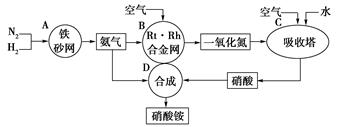
 (1)吸收塔C中通人空气的目的是
(1)吸收塔C中通人空气的目的是
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H=-1266.8kJ/mol
N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式:
(3)已知:N2(g)+3H2(g)  2NH3(g);△H=-92kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g);△H=-92kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为25%,此时H2的转化率为 。
在一定温度下,有1mol N2和3mol H2发生下列反应:
N2(g)+3H2(g) 2NH3(g)△H<0。
2NH3(g)△H<0。
(1)若在相同温度下,分别在1L定压密闭容器A中和1L定容密闭容器B中反应:达到平衡所需的时间t(A)t(B)(填“大于”“小于”或“等于”,下同)。平衡时是N2的转化率α(A)α(B)。
(2)若在上述定压密闭容器A中,反应已达到平衡时,再加入0.5 mol氩气,则N2的转化率如何变化(填“增大”“减小”“不变”,下同)。正反应速度与原平衡相比,有无变化,并简要说明理由。
按要求书写下列热化学方程式
(1)N2(g)和H2(g)反应生成1molNH3(g)放出46.1KJ热量
(2)航天领域使用氢氧燃烧电池有酸式和碱式两种,它们放电时的总反应可以表示为2H2 + O2 =2H2O,酸式氢氧燃烧电池的电解池是酸。其负极反应可以表示为2H2-4e-=4H+,则其正极反应可以表示为;;碱式氢氧燃烧电池的电解质是碱,其正极反应可以表示为:O2+2H2O+4e-=4OH-,则其负极反应可以表示为:。
(3)用石墨作电极电解NaCl水溶液
阳极的电极反应,阴极的电极反应
(4)在粗铜精炼的反应中
当阳极,发生(填“氧化”或“还原”)反应,
阳极的电极反应
(5)将H+、Cu2+、SO42-、Cl-五种离子组成电解质按要求进行电解:以碳棒为电极,使电解质质量减少,水量不变进行电解,应采用的电解质是、;
F是新型降压药替米沙坦的中间体,可由下列路线合成: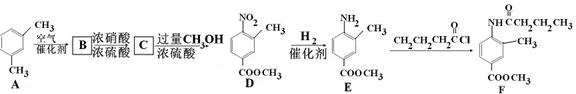
(1)反应类型: D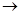 E:___ _,E
E:___ _,E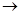 F:____。
F:____。
(2)写出满足下列条件的B的所有同分异构体 __________ (写结构简式)。
①含有苯环②含有酯基③能与新制Cu(OH)2反应
(3)C中含有的官能团名称是 ________________________。已知固体C在加热条件下可溶于甲醇,下列C D的有关说法正确的是。
D的有关说法正确的是。
a、D的化学式为C9H9NO4
b、浓硫酸的吸水性可能会导致溶液变黑
c、甲醇既是反应物,又是溶剂
(4)E的同分异构苯丙氨酸经缩聚反应形成的高聚物是 ____(写结构简式)。
(5)F在强酸和长时间加热条件下发生水解反应的化学方程式是 _____。
已知有机物A分子中有3个碳原子,有关它的某些信息注明在下面的示意图中: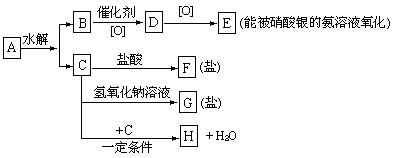
(1 )A、F、G的结构简式为:___________,____________,______________.
(2) 生成H的化学方程式为:__________________________________.
某学生取18g淀粉溶于水,为测定淀粉的水解百分率,其程序如图: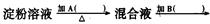
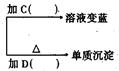
(1)各步所加试剂为:A、B、C、D。
(2)只加A溶液而不加B溶液是否可以,理由。
(3)当析出2.16g沉淀时,淀粉水解率为。