在一定温度下,有1mol N2和3mol H2发生下列反应:
N2(g)+3H2(g) 2NH3(g)△H<0。
2NH3(g)△H<0。
(1)若在相同温度下,分别在1L定压密闭容器A中和1L定容密闭容器B中反应:达到平衡所需的时间t(A) t(B)(填“大于”“小于”或“等于”,下同)。平衡时是N2的转化率α(A) α(B)。
(2)若在上述定压密闭容器A中,反应已达到平衡时,再加入0.5 mol氩气,则N2的转化率如何变化 (填“增大”“减小”“不变”,下同)。正反应速度与原平衡相比,有无变化,并简要说明理由 。
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+ O2 (g)  2SO3(g) ;△H<0
2SO3(g) ;△H<0
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速度 (以上均填增大、减小或不变)
下列方法中可以证明2HI(g) H2(g)+I2(g)已达平衡状态的是( )
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③百分组成HI%=I2%
④反应速率υ(H2)=υ(I2)=0.5υ(HI)时
⑤ [HI]=[H2]=[I2]=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时混合气体的颜色不再变化
⑩温度和压强一定时混合气体密度不再变化
在一定温度下,反应2NO2  N2O4达平衡的标志是 。
N2O4达平衡的标志是 。
| A.混合气颜色不随时间的变化 |
| B.数值上v(NO2生成)=2v(N2O4消耗) |
| C.单位时间内反应物减少的分子数等于生成物增加的分子数 |
| D.压强不随时间的变化而变化 |
E.混合气的平均分子量不变
在一容积固定的反应容器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下: A、 B和C均为4.0mol, D为 6.5mol, F为2.0mol,设E为xmol,x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中间位置。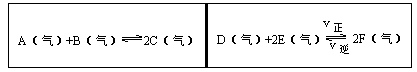
①若x=4.5,则右侧反应在起始时向______方向进行,欲使起始反应维持向该方向进行,则x的取值范围为____ 。
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______,其理由是______。
用金属钠制取Na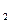 O,通常用NaNO
O,通常用NaNO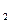 和Na反应:2NaNO
和Na反应:2NaNO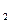 +6Na
+6Na 4Na
4Na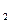 O+N
O+N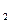 ↑。试解释为什么采用这种方法制取而不用钠在氧气中燃烧的方法。
↑。试解释为什么采用这种方法制取而不用钠在氧气中燃烧的方法。