北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。请回答下列问题: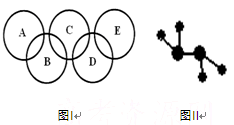
(1)火焰利用了部分金属的______反应,该反应属于______(填“物理”或“化学”)变化。
(2)右图Ⅰ所示的五圆环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素。 A是沼气的主要成分;B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型如图Ⅱ;C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
A是沼气的主要成分;B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型如图Ⅱ;C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为 ,D的化学式是 。
② A、B、E中均含有的一种元素为 (填元素名称)。
③NH3分子中的N原子有一对孤对电子,能发生反应:NH3 + HCl = NH4Cl。试写出E与足量盐酸发生反应的化学方程式 。
(3)我国科研人员在实验室应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似。已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60分子的结构中含有_________个N—N键。
BaSO4在水中存在沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。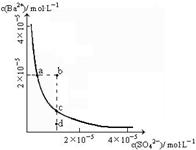
(1)某温度时,BaSO4的沉淀溶解平衡曲线如图所示。下列说法正确的是______
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
(2)在胃部透视时,服用的“钡餐”的主要成分是硫酸钡。在25℃时,硫酸钡的溶度积常数约为1.21×10—10。
①Ba2+是一种有毒的重金属离子,当人体中c(Ba2+)达到2×10—3mol·L-1时,就会对健康产生危害。硫酸钡作为“钡餐”的理由。
②在25℃时,1L水中约能溶解0.0197g碳酸钡,且胃液是酸性的,(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”,理由是
(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)醋酸钠水溶液PH7 ,(填“>”、“=”、“<”)原因是(用离子方程式表示):______。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)氯化铵溶液中滴加适量氨水,至溶液呈中性,则c(Cl-)c(NH4+)(填“>”、“=”、“<”)。(4)在25℃下,某浓度Na2CO3溶液中由水电离出来c(OH-)=1×10-6 mol/L,则此溶液的PH值为
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________,
K值的大小与温度的关系是:温度升高,K值__________(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)高炉炼铁中发生的基本反应之一为:CO(g) + FeO(s) CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
①升高温度,平衡移动达到新的平衡时,高炉内CO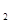 和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
②1100℃时测得高炉中c(CO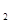 )="0.025"
)="0.025" 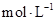 ,
,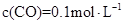 ,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度
,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度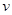 (正)__________
(正)__________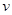 (逆)(选填“>”、“<”或“:”),其原因是________________。
(逆)(选填“>”、“<”或“:”),其原因是________________。
(1)有一部分化学反应的反应热测定起来很困难,我们可以根据盖斯定律计算获得。如同素异形体之间的转化反应热数值小且转化慢,测定较困难。已知:
①4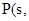 白磷
白磷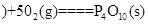 △H=-2983.2KJ/mol
△H=-2983.2KJ/mol
②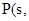 红磷
红磷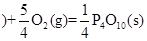 △H=-738.5KJ/mol
△H=-738.5KJ/mol
写出白磷转化为红磷的热化学方程式:__________________________。则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是_______。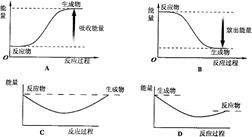
(2)(6分)有右图装置:回答下列问题: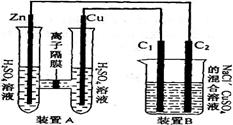
①装置A是_______池,B是_______池。
②装置A中的Zn极是_______极,Cu极上的电极反应方程式为:___。
③锌与铁组成的合金在潮湿的空气中,锌被腐蚀而另一种金属被保护,这种保护方法称为
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e- ="=" 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
(1)将反应Zn + 2H+ = Zn2+ + H2↑拆写为两个“半反应式”:其中,氧化反应为:。
(2)由题(1)反应,设计成原电池如图所示: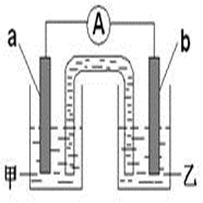
若电极a为Zn ,电极b可选择材料:(只填一种);电解质溶液甲是;电极b处的电极反应式:。
(3)由反应2H2 + O2 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极,正极。
2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极,正极。