有A、B、C、D、E、F六种元素。A是宇宙中最丰富的元素;B是周期表中电负性数值最大的元素;C的基态原子中2p轨道有三个未成对的单电子;F原子核外电子数是B与C核外电子数之和;D是主族元素,且与副族元素E同周期;E能分别形成红色(或砖红色)的E2O和黑色的EO两种氧化 物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。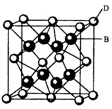
(1)E元素原子基态时的外围电子排布式为 。
(2)A2F分子中F原子的杂化类型是 ,F的气态氧化物FO3分子的键角为 。
(3)CA3极易溶于水,其原因是 ,试判断CA3溶于水后,形成CA3·H2O的最合理结构为 (选填字母)。
(4)从晶胞结构图中可以看出,D跟B形成的离子化合物的电子式为 ;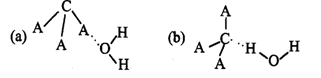
该离子化合物晶体的密度为ρ(g·cm-3)。,则晶胞的体积是 (只要求列出算式)。
(5分) 某有机物气体含碳82.7%,含氢17.3%,在标准状况下它的密度是2.59g/L。则(1)此有机物的相对分子质量为____________;(2)此有机物的分子式为____________;其可能的结构简式为
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 5.00%的
5.00%的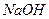 溶液、足量的
溶液、足量的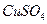 溶液和l00
溶液和l00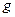 10.00%的
10.00%的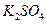 溶液.电极均为石墨电极。
溶液.电极均为石墨电极。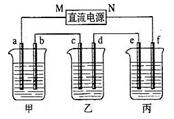
(1)接通电源,经过一段时间后,测得丙中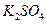 浓度为10.47%,乙中c电极质量增加。据此回答问题:
浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状况下的体积: ;
④电极c的质量变化是  ;
;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出.此时电解能否继续进行,为什么? 。
从H+、Cu2+、Na+、SO42-、Cl-五种离子中恰当地组成电解质,按下列要求进行电解:
(1)以石墨为电极进行电解,使电解质质量减少,水质量不变,可采用的电解质有__________
(2)以石墨为电极进行电解,使电解质质量不变,水质量减少,可采用的电解质有_________(3)以石墨为电极进行电解,使电解质和水的质量都减少,可采用的电解质有
(5分) (1)常温下,pH=11的NaOH溶液稀释1000倍后溶液的pH为,稀释105倍后溶液的pH为
(2)在pH为11的Ba(OH)2溶液中,溶质的物质的量浓度为mol/L,水电离出的C(OH-)为mol/L
(3)25℃时,将pH=10和pH=12的NaOH溶液等体积混合,混合后溶液的pH=。
(1)写出下列物质的电离方程式:
①H2S:
②NaHCO3溶于水:③NaHSO4溶于水:
(2)下出下列盐的水解方程式(离子方程式):
①NH4Cl:
②明矾净水原理(只写相应离子的水解方程式):
③泡沫灭火器(硫酸铝和碳酸氢钠)的灭火原理:
(3)写出难溶电解质的溶度积表达式。Mg(OH)2:
(4)下出下列反应方程式:
①钢铁发生吸氧腐蚀的正极反应式:
②氢氧燃料电池,H2SO4做电解质溶液,正极反应式:
③电解饱和食盐水的总反应方程式: