对下列各溶液中,微粒的物质的量浓度关系表述正确的是
| A.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+) >c(OH-)>c(H+)() |
| B.在NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C.将相同物质的量浓度的某弱酸(A-为弱酸根)溶液与KA溶液等体积混匀,测得混合后溶液pH=10,则混合液中c(K+)>c(A-) |
| D.0.1 mol·L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
已知下列数据:Fe(s) + 1/2O2(g) = FeO(s) ΔH=-272kJ/mol;2Al(s) + 3/2O2(g) = Al2O3(s) ΔH=-1675kJ/mol;则2Al(s) + 3FeO(s) = Al2O3(s) + 3Fe(s)的ΔH是
| A.-859 kJ/mol | B.+859 kJ/mol | C.-1403 kJ/mol | D.-2491 kJ/mol |
下列有关吸热反应、放热反应的叙述中,正确的是
①如果反应物的总能量低于生成物的总能量,该反应一定是吸热反应。
②只要是在加热条件下进行的反应,一定是吸热反应
③只要是在常温常压下进行的反应,一定是放热反应
④中和反应和燃烧反应都是放热反应
⑤化合反应都是放热反应
⑥原电池反应可能是放热反应,也可能是吸热反应
| A.① ④ | B.① ② ③ | C.④ ⑤ ⑥ | D.① ④ ⑤ ⑥ |
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为
| A.0.5 mol/L | B.1.0 mol/L |
| C.2.0 mol/L | D.3.0 mol/L |
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合图。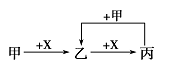
其中甲和X不可能是
| A.甲为Fe,X为Cl2 |
| B.甲为SO2,X为NaOH溶液 |
| C.甲为C,X为O2 |
| D.甲为AlCl3溶液,X为NaOH溶液 |
下列离子方程式书写正确的是
| A.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
B.向 NaHSO4溶液中滴加Ba(OH)2溶液至中性: H++SO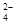 +Ba2++OH- +Ba2++OH-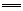 BaSO4↓+H2O BaSO4↓+H2O |
| C.用氯化铁溶液腐蚀铜板:Cu+Fe3+===Cu2++Fe2+ |
| D.用烧碱溶液吸收氯气:Cl2+2OH-==Cl-+ClO-+H2O |