关于下图所示装置的叙述,正确的是( )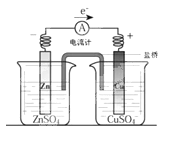
| A.铜是阳极,铜片上有气泡产生 |
| B.铜离子在铜片表面被还原 |
| C.电流从锌片经导线流向铜片 |
| D.正极附近的SO42-离子浓度逐渐增大 |
反应C(s)+H2O(g) CO(g)+H2(g),在一可变容积的密闭容器中进行, 下列条件改变对其反应速率几乎无影响的是( )
CO(g)+H2(g),在一可变容积的密闭容器中进行, 下列条件改变对其反应速率几乎无影响的是( )
| A.增加C的量 | B.体积缩小一半 |
| C.体积不变,充入氮气使压强增大 | D.压强不变,充入氮气使体积增大 |
对于可逆反应H2(g)+I2(g) 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A.H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B.反应进行的净速率是正、逆反应速率之差 |
| C.正、逆反应速率的比值是恒定的 |
| D.达到平衡时,正、逆反应速率相等 |
可逆反应H2(g) + I2(g)  2HI(g)达到平衡的标志是( )
2HI(g)达到平衡的标志是( )
| A.H2、I2、HI的浓度相等 | B.H2、I2、HI的浓度保持不变 |
| C.混合气体的密度保持不变 | D.混合气体的质量不再改变 |
使反应4NH3(g)+3O2(g)===2N2(g)+6H2O(g)在2 L的密闭容器中进行,半分钟后N2的物质的量增加了0.6 mol。此反应的平均反应速率可表示为( )
| A.v(NH3)=0.02 mol·L-1·s-1 | B.v(O2)=0.01 mol·L-1·s-1 |
| C.v(N2)=0.02 mol·L-1·s-1 | D.v(H2O)=0.02 mol·L-1·s-1 |
下列说法中有明显错误的是( )
| A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.活化分子之间发生的碰撞不一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加入适宜的催化剂,使分子能量增加从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率 |