某原电池的电池反应为:Fe+2Fe3+= 3Fe2+,与此电池反应不符的原电池是( )
| A.铜片、铁片、FeCl3溶液组成的原电池 | B.石墨、铁片、Fe(NO3)3溶液组成的原电池 |
| C.铁片、锌片、Fe2(SO4)3溶液组成的原电池 | D.银片、铁片、Fe(NO3)3溶液组成的原电池 |
X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的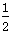 。下列说法正确的是
。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线形的共价化合物 |
| C.CaX2、CaM2和CaZ2等3种化合物中,阳离子与阴离子个数比为1∶2 |
| D.由X、Y、Z、M四种元素共同形成的化合物中一定有共价键可能有离子键 |
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是
| A.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B.b曲线表示的是向X溶液中加入NaOH溶液 |
| C.在O点时两方案中所得溶液浓度相等 |
| D.a、b曲线表示的反应都是氧化还原反应 |
某溶液中可能含有I-、NH4+、Cu2+、SO32-、Cl-,向该溶液中加入少量溴水,振荡后溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I- ⑤可能含有SO32-
| A.②④⑤ | B.①②③ | C.②③④ | D.①②⑤ |
下列实验过程中产生的现象与对应的图形相符合的是
| A.NaHSO3粉末加入HNO3溶液中 |
| B.SO2气体通入新制氯水 |
| C.NaOH溶液滴入Ba(HCO3)2溶液中 |
| D.CO2气体通入澄清石灰水中 |




常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32- |
| B.澄清的溶液中:Na+、K+、MnO4—、AlO2— |
C. =10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3- =10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3- |
| D.c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42- |