反应2X(g)+Y(g) 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )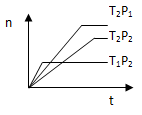
| A.T1<T2,P1<P2 | B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 | D.T1>T2,P1<P2 |
化学与生产和生活密切相关,下列说法正确的是
| A.误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
| B.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
| C.浸泡过高锰酸钾溶液的硅藻土放于水果箱内是为了延长水果保鲜期 |
| D.安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则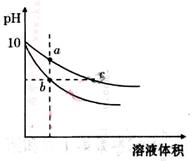
| A.b、c两点溶液的导电能力相同 |
B.c点溶液中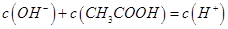 |
| C.a、b、c三点溶液中水的电离程度a>c>b |
D.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积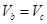 |
下列有关实验操作、现象或原理均正确的是
| 选项 |
实验操作 |
实验现象或原理 |
| A |
将海带灼烧,加水浸泡后过滤,向滤液中加入CCl4,振荡后静置 |
液体分层,下层显紫红色 |
| B |
向氢氧化铝胶体中逐滴加入稀盐酸或氢氧化钠稀溶液 |
均先出现沉淀后溶解 |
| C |
将40.0gNaoH固体溶于1.0L蒸馏水中配成溶液 |
NaOH的物质的量浓度为1.0mol/L |
| D |
向BaSO4饱和溶液中加入饱和Na2CO3溶液 |
有白色沉淀产生,说明Ksp(BaSO4)大于Ksp(BaCO3) |
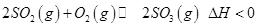 是制备硫酸的重要反应。下列说法正确的是
是制备硫酸的重要反应。下列说法正确的是
A.加入催化剂,反应速率加快,反应的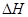 变大 变大 |
B.将平衡后的混合气体用浓硫酸吸收,剩余的气体只有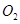 |
| C.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% |
| D.若以稀硫酸为电解液,将该反应设计成原电池,放电过程中负极附近溶液的pH不断减小 |
下列叙述正确的是
| A.FeCl3溶液中加入镁粉有气泡产生 |
| B.C12、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| C.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D.向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |