下列说法正确的是( )
| A.难溶电解质的溶度积Ksp越小,则它的溶解度越小 |
| B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示 |
| C.溶度积常数Ksp与温度有关,温度越高,溶度积越大 |
| D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小 |
甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),在这个过程中,下列描述不合理的是( )
| A.碳原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的稳定性发生了改变 | D.微粒中的键角发生了改变 |
有机物CH3—CH==CH—Cl能发生的反应有()
①取代反应②加成反应③使溴水褪色④使酸性KMnO4溶液褪色⑤与AgNO3溶液生成白色沉淀⑥聚合反应
| A.以上反应均可发生 | B.只有⑥不能发生 |
| C.只有⑤不能发生 | D.只有②不能发生 |
下列说法不正确的是( )
| A.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| B.甲烷和苯都能发生取代反应和氧化反应 |
| C.甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| D.乙烯、乙炔都能使溴水褪色,原理相同 |
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )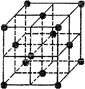
| A.C60摩尔质量是720 |
| B.C60与苯互为同素异形体 |
| C.在C60晶胞中有14个C60分子 |
| D.每个C60分子周围与它距离最近等距离的C60分子有12个 |
下列各组物质的性质排序正确的是( )
| A.酸性:H3PO4>H2SO4>HClO4 | B.水溶性:NH3>CO2>SO2>H2S |
| C.热稳定性:HF>H2O>NH3 | D.沸点:新戊烷>正戊烷>丁烷 |