2NO+O2  2NO2+Q(Q>0)
2NO2+Q(Q>0)
图中的曲线是表示其他条件一定时, 反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的是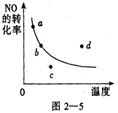
| A.a点 | B.b点 | C.c点 |
D.d点 |
根据下列实验操作和现象所得出的结论不正确的是
下列离子方程式正确的是
| A.lmol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+ HCO3-=CaCO3↓+H2O |
| C.AlCl3溶液中加入过量氨水:Al3++4 OH-= AlO-2+2H2O |
| D.向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+= Ag++2NH4++ H2O |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.在反应中消耗1mol Cl2,转移的电子数一定为2NA |
| B.标准状况下,0.5mol氦气含有的电子数为NA |
| C.15gCH3+(碳正离子)中含有电子数为10NA |
| D.0.1L 2 mol·L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
下列排列顺序不正确的是
| A.熔点:Al>K>Na | B.微粒的半径:Cl- >Na+>Mg2+>Al3+ |
| C.热稳定性:HF>HCl>HBr>HI | D.结合质子能力:AlO-2>CO32->F- |
恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆
H2(g) +I2(g)  2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:
2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:
下列判断正确的
| A.平衡时,乙中颜色更深,a>0.008 |
| B.平衡时,放出的热量:Q1=1/2Q2 =0.149kJ |
| C.该温度下,该反应的平衡常数K="4" |
| D.平衡后,向甲中再冲入0.004 mol HI气体,再次达到平衡时HI的百分含量不变 |