已知A、B为单质,C为化合物。能实现上述转化关系的是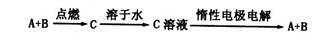
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.③④ C.①③ D.②④
下列叙述正确的是()
| A. | 1个甘氨酸分子中存在9对共用电子 |
| B. | 和 分子中所有原子的最外层都达到8电子稳定结构 |
| C. | 和 分子都是含极性键的极性分子 |
| D. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
(1)C(s,石墨)+O2(g)====CO2(g);
ΔH="-393.51" kJ·mol-1
(2)C(s,金刚石)+O2(g) ====CO2(g);
ΔH="-395.41" kJ·mol-1
据此判断,下列说法中正确的是
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3+N2+3C 2AlN+3CO。下列叙述正确的是
2AlN+3CO。下列叙述正确的是
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3 |
| D.氮化铝晶体属于分子晶体 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2====4Fe(OH)3 |
| B.2Fe+2H2O+O2====2Fe(OH)2↓ |
C.2H2O+O2+4e- 4OH- 4OH- |
D.Fe Fe3++3e- Fe3++3e- |
β′Al2O3陶瓷作固体电解质,反应式如下:2Na+xS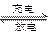 Na2Sx,以下说法正确的是
Na2Sx,以下说法正确的是
| A.放电时,Na作正极,S极发生还原反应 |
| B.若用此电池电解硝酸银溶液,当阴极上产生标准状况下气体1.12 L时,消耗金属钠2.3 g |
| C.充电时,钠极与外电源的正极相连 |
D.充电时,阳极发生的反应为  xS+2e- xS+2e- |