(10分)已知25℃时部分弱电解质的电离平衡常数数据如下表:  回答下列问题:
回答下列问题:
(1)物 质的量浓度均为0.1mol·L一1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
质的量浓度均为0.1mol·L一1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;
pH由小到大的排列顺序是_______________________(用字母表示)
(2)常温下,0.1mol·L—1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_______________(填序号)
| A.c(H+) | B.c(H+)/c(CH3COOH) |
| C.c(H+)·c(OH—) | D.c(OH-)/c(H+) |
(3)体积均为l00mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数___________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。理由是:______________________________________。
(4)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中
c(CH3COO—)—c(Na+)=_______mol·L—1(填精确值),c(CH3COO-)/c(CH3COOH)=_______。
(共8分)在恒温恒容的密闭容器中通入1mol N2和Xmol H2发生如下反应:N2+3H2 2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
(1)起始时充入H2的物质的量为mol,氢气的转化率为;
(2)该反应的热化学方程式为;
(3)若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同。若维持反应向正方向进行,则起始时c的取值范围是。
(5分)(1)请指出乙烯的一种用途:。
(2)将乙烯通入到溴的四氯化碳溶液中,其化学方程式为:反应的类型是;
(3)甲烷与氯气反应生成气态有机物的反应方程式反应的类型是。
根据下图回答以下问题: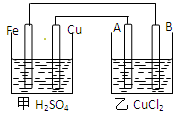
(A、B均为碳棒,两池中溶液均足量)
(1)甲装置是池,乙装置是池且Fe极为极,A极为极
(2)A极的电极反应
(3)若甲池中Fe溶解0.3 mol,则乙池中产生气体的总体积(标准状况)为L,
乙池极质量会增加g
(1)已知:一定量CH4完全燃烧生成CO2和液态水时,放出热量QkJ;若将燃烧产物全部通入过量的澄清石灰水,可得到20g沉淀,请写出CH4燃烧的热化学方程式
(2)请写出:氢氧燃料电池的正极电极反应式(电解质溶液为稀硫酸)
己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式;V原子的结构示意图;
Z的氢化物结构式为;写出U元素在周期表中的位置
N2W2中含有的化学键的种类
(2)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量澄清石灰水反应的离子方程式为。
(3)从化合价升降的角度推测UW2与V元素的单质在水溶液中反应的化学方程式是。