为测定 FeO 和 Fe2O3 固体混合物中 Fe元素的含量,可用氢气还原一定质量的此混合物并测定生成水的质量的方法来完成。若在实验室中选用下列实验装置来实现上述目的(图中夹持装置已略去,部分装置可重复使用)。请填空:
⑴仪器X的名称是 。
⑵写出A中发生反应的离子方程式 ,
实验前如何检验装置A的气密性 。
⑶下图所示装置中与A装置具有相同作用的是 (填装置编号)。
⑷按正确的实验设计,所连接的装置顺序为:A→C→ → → 。
⑸若FeO和Fe2O3混合物的质量为 ag,反应完全后生成水的质量为 b g,则混合物中
Fe元素的质量分数为 (用含字母的数学式表示)。
某有机物X的相对分子质量小于100,1mol有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2 112 L。
(1)该有机物X的分子式为。
a.C4H8 b.C2H4O c.C4H8O2 d.C10H20O20
(2)甲物质是X的同分异构体,物质甲能发生如下图所示的转化:
①B的名称是。甲的结构简式是
②A→D的反应类型为,E→F的反应条件是。
③写出F→G的化学方程式:。
(3)物质乙也是X的同分异构体,1mol乙与足量的Na反应可生成1mol H2,且乙不能使溴的CCl4溶液褪色,乙有3种性质的氢原子,其结构简式可能是
H2,且乙不能使溴的CCl4溶液褪色,乙有3种性质的氢原子,其结构简式可能是
物质A~E都是由下表中离子组成的,常温下各物质从1mL稀释到1000mL,pH的变化如图甲所示,其中A与D反应得到E。请回答:
| 阳离子 |
NH4+、H+、Na+ |
| 阴离子 |
OH-、CH3COO-、Cl- |

(1)根据pH的变化关系图甲,写出物质的化学式:B:,D:。
(2)图甲a>9的理由是
(3)另取浓度为C1的B溶液25mL,向其中逐滴滴加0.2mol/L的D溶液,滴定过程中溶液pH的变化曲线如乙图所示。
①C1为;
②G点溶液呈中性则滴加入D溶液的体积V12.5mL(填>,<或=)
③常温下B、C溶液的pH分别是a、b且a+b=13则将B、C混和恰好完全 反应时所消耗B、C溶液的体积比VB:VC=
反应时所消耗B、C溶液的体积比VB:VC=
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。
(1)元素T的名称是
(2)J和氢元素组成的化合物A每个分子由4个原子组成,已知充分燃烧a gA物质时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则A物质燃烧热的热化学方程式是
(3)工业燃烧焦炭后的尾气中含有M和R组成的气体,为了测定其含量,可以选择的试剂是
| A.氢氧化钠溶液 | B.硫酸酸化的高锰酸钾溶液 | C.淀粉碘化钾溶液 | D.溴水溶液 |
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:
(5)由L和M组成的 两种价态相同的气体化合物可以相互转化,在同温同容的甲乙容器中分别加入1mol和2mol的LM2气体,分别建立平衡,则两容器中LM2的转化率比较甲乙(<,>,=)
两种价态相同的气体化合物可以相互转化,在同温同容的甲乙容器中分别加入1mol和2mol的LM2气体,分别建立平衡,则两容器中LM2的转化率比较甲乙(<,>,=)
(6)与J同主族的另一短周期元素和M组成的化合物有很广泛的用途,请说出其主要应用,写出两种
现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。(由实验装 置引起的实验误差忽略不计)。
置引起的实验误差忽略不计)。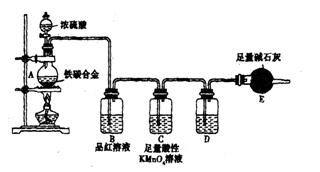
Ⅰ.探究 浓硫酸的某些性质
浓硫酸的某些性质
(1)称量E的质量;按照图示连续装置,检查装置的气密性。
(2)将mg铁碳合金样品放入A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B均无明显现象,其原因是:。点燃酒精灯一段时间后,B中可观察到的明显现象是。
C中足量的酸性KMnO4溶液所起的作用是。D中盛放的试剂是。
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是。
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg,则铁碳合金中铁的质量分数为(写表达式)。某同学认为:依据此实验测得的数据,计算合金中铁的质量 分数可能会偏低,你认为可能的原因是。
分数可能会偏低,你认为可能的原因是。
(5)经过大家的讨论,决定采用右图装置和其他常用实验仪器测定某些数据即可,为了快速和准确地计算出铁的质量分数,最简便的实验操作是(填写代号)。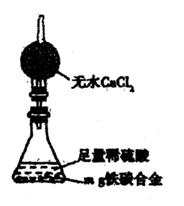
①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③测定反应前后装置和药品的总质量
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题: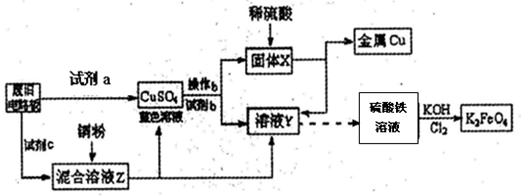
据此回答问题
(1)试剂a为试剂b为 (填写所选试剂代号)
| A.浓硫酸 | B.硫酸铁溶液 | C.氯水 | D.H2 O2和稀硫酸 E. Fe |
(2)加入过量试剂c,发生反应的离子方程式为__;溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为__ _ _(填化学式);欲测定溶液Z中Fe2+的浓度,需要用(填仪器名称)__ __配制一定浓度的KMnO4标准溶液。在滴定时KMnO4标准溶液应加入到(填“酸式”或“碱式”)滴定管中。
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O="=" 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为。K2Fe04与FeCl3相比,净水效果更好的是_,理由是。
(4)高铁电池是一种新型可充电电池,总反应为:3Zn +2K2FeO4 +8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:。
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:。