铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2  6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
(4)钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。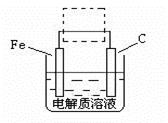
(8分)在一体积为1 L的容器中,通入一定量的N2 O4,在100℃时发生如下反应:
(1)在0-60s这段时间内,以N2O4表示的平均反应速率为mol·L-1·s-1
(2)上述反应的平衡常数表达式为,升高温度K值(填“增大"、“减小”或“不变”)
(3)反应进行到100s时,若有一项条件发生变化,变化的条件不可能是(填选项序号)。
| A.降低温度 | B.通人氦气使其压强增大 | C.又往容器中充入N2O4 | D.使用催化剂 |
(4分)已知:C(s)+O2(g)  CO2(g)ΔH="-437.3" kJ·mol一1
CO2(g)ΔH="-437.3" kJ·mol一1
H2(g)+ O2(g)
O2(g)  H2O(g)ΔH ="-285.8" kJ·mol一1
H2O(g)ΔH ="-285.8" kJ·mol一1
CO(g)+ O2(g)
O2(g)  CO2(g)ΔH ="-283.0" kJ·mol一1
CO2(g)ΔH ="-283.0" kJ·mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是
(8分)四种短周期非金属元素A、B、C、D,原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是。
(2)化合物CA3的电子式是,BD2分子的结构式为。
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为。
某些化学反应可用下式表示(未配平):A+B→C+D+H2O
请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,写出该反应的离子方程式:___________________________________________。
(2)若C为氯化钠,D是能使澄清石灰水变浑浊的无味气体,则A与B的组合是(填俗名):A________________或________________ , B______________________。
(3)若A为紫红色金属,D为无色刺激性气体,请写出符合上式的化学方程式:____________________________________________。
(4)若C、D均为气体且分子具有相同的原子个数比,则符合上式化学方程式是:____________________________________________。
(5)若A为过氧化钠,B为硫酸,则C是____________,D是_______________。
用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
请回答下列问题:
I.(1)仪器p的名称是_________________,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 |
① |
② |
③ |
| 所蘸试剂 |
石蕊试液 |
品红溶液 |
碘水(黄色) |
| 现象 |
褪色 |
||
| 体现SO2的性质 |
水溶液显酸性 |
(2)写出③中反应的离子方程式_________________________________________。
II.若用装置A由浓盐酸和高锰酸钾制取Cl2气体,装置B中的四处棉花依次做了如下处理:①蘸有FeCl2溶液②蘸有淀粉KI溶液③蘸有石蕊溶液④蘸有品红溶液
(1)写出①处发生反应的离子方程式_______________________________________。
(2)在实验过程中,③处能观察到的现象___________________________________。
(3)写出装置C中“吸收多余气体”所用的试剂_______________________________