2011年4月,继上海、浙江温州“染色馒头”事件之后不久,辽宁沈阳又发生了“毒豆芽”事件。本来生产豆芽过程中是不允许使用任何添加剂的。但在“毒豆芽”至少使用了4种添加剂,其中加入尿素和6-苄氨基腺嘌呤(化学式为C12H11N5)可使豆芽长得又粗又长,而且可以缩短生产周期,增加黄豆的发芽率。但是人食入后,会在体内产生亚硝酸盐,长期食用可致癌。6-苄氨基腺嘌呤化学式为C12H11N5,请回答下列问题:
(1)6-苄氨基腺嘌呤中碳、氢、氧三种元素的原子个数比为 。
(2)6-苄氨基腺嘌呤中氮元素的质量分数为 (保留一位小数)。
(3)如果食用的“毒豆芽”时,6-苄氨基腺嘌呤中的氮元素有20%会转化成亚硝酸钠(NaNO2),则每食用45g的6-苄氨基腺嘌呤,在我们体内会产生致癌物质亚硝酸钠(NaNO2)_______g。
请根据下列实验装置图回答问题: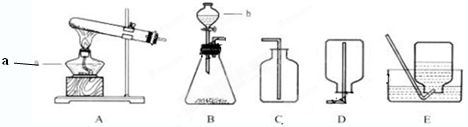
(1)写出仪器a、b的名称。a是_____________;b是_____________。
(2)若想制取CO2,应选择图中的_______装置,选用的收集装置为(填序号),反应的化学方程式是____________________________。
(3)甲烷(CH4)是密度小于空气、难溶于水的气体,实验室用加热无水醋酸钠和碱石灰的固体混合物制取甲烷。制取甲烷的发生装置应选择 (填装置编号,下同),收集装置应选 ;请写出甲烷完全燃烧的化学方程式____________________。
今年我市化学实验操作考察的实验之一是“高锰酸钾制取氧气”。现摘录某同学的实验过程如下:
①选择适当仪器,组装成如图所示的实验装置;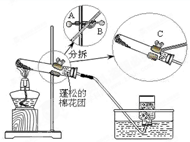
②检查装置气密性,装置气密性良好;
③向集气瓶中加水,并倒置于盛有水的水槽中,集气瓶底部出现气泡;
④将药品平铺于干燥试管底部,在导管口放置蓬松的棉花团,塞上橡皮塞,固定于铁架台上;
⑤点燃酒精灯加热,待导管口有气泡产生,立即用集气瓶进行收集;
⑥气体收集完毕,用毛玻璃片将集气瓶口盖好,从水中取出并正放在桌面上;
⑦先熄灭酒精灯,后将导管从水槽中取出;
请回答下列问题:
(1)写出用高锰酸钾制氧气的化学方程式:,其中二氧化锰是。
(2)欲调整试管高度,应调节图中A、B、C哪个旋钮:;
(3)步骤②的正确操作后观察到的现象是;若装置无破损,加热一段时间后,观察到高锰酸钾已大量分解,但导管口仍未产生明显气泡,可能的原因是;
(4)上述实验步骤中,可能导致集气瓶中收集的氧气不纯净(水蒸气不计)的是;(填序号)
(5)步骤⑦中的操作,可能引起试管炸裂,原因是。
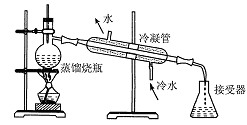
小刚收集到一瓶浑浊的长江水,他要模拟自来水厂的净水过程,最终制成蒸馏水,其实验过程如下所示。请回答以下问题。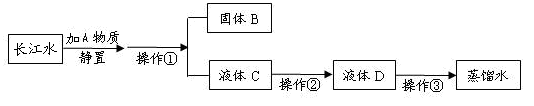
(1)A物质的名称是,操作①的名称是,若经过操作①后,所得液
体C中仍有浑浊,其原因可能是(填写序号);
a.漏斗内的滤纸有破损缘b.漏斗下端未靠在烧杯内壁
c.漏斗内液面高于滤纸的边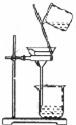

(Ⅰ)(Ⅱ)(Ⅲ)
(2)操作②主要是除去一些异味和色素,应选用的装置是(填序号),该过程主
要是变化(填“物理”或“化学”)。
(3)小刚取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明液体D是水。操作③应选用的装置是(填序号),经过操作③以后,小刚重复上述实验,他观察到的实验现象是。
下图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种微粒的结构示意图。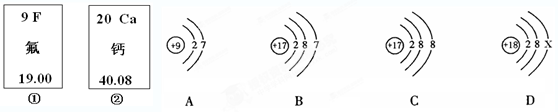
请你回答:(1)X=;
(2)氟元素的相对原子质量为,钙元素的原子序数为;
(3)A、B、C、D中属于同种元素的微粒是(填序号);
(4)A微粒的化学性质与B、C、D中哪一种微粒的化学性质相似(填序号);
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。
下列各组微粒中属于等电子体的是(填字母序号)。
A.NO和O2 B.CO和N2 C.SO2和CO2 D.PO43—和SO42—
2010年4月14日,青海玉树发生7.1级地震。全国人民抗震救灾,众志成城,彰显了中华民族巨大的凝聚力。请回答下列问题:
(1)部分救灾人员感到呼吸困难,因为玉树地区海拔高,空气中的O2 ________________。
A.不能供给呼吸B.体积分数偏小 C.比低海拔地区稀薄
(2)在救灾过程中,某些设备需要使用锂电池。锂电池中总的化学反应可表示成:Li+MnO2=LiMnO2,其中反应前后Li元素的化合价变化情况是:0→+1,则Mn元素的化合价变化情况为:+4→____________。
(3)确保饮用水安全是灾后重建的头等大事,静置、沉淀、吸附、过滤、消毒等都是常用的净水方法。判断净化后的水是硬水或软水,可加入少量肥皂水或用进行检验,生活中常用的方法来降低水的硬度。
(4)天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是。
(5)国家药监局公布的抗震救灾急需药械目录中包括:一次性防护服、活性炭防护口罩、骨科内外固定材料等。其中防护口罩主要利用了活性炭的___________性。