等质量的①CH4、②H2、③HCl、④SO2,在标况下体积由大到小顺序是( )
| A.②>①>③>④ | B.④>③>①>② |
| C.③>②>④>① | D.①>④>②>③ |
X、Y两根金属棒插入Z溶液中构成下图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的()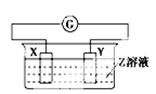
| 编号 |
X |
Y |
Z |
| A |
Zn |
Cu |
稀硫酸 |
| B |
Cu |
Zn |
稀硫酸 |
| C |
Cu |
Ag |
硫酸铜溶液 |
| D |
Ag |
Zn |
硝酸银溶液 |
在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是()
C(g)+D(g)已达平衡的是()
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.混合气体的平均相对分子质量 |
根据热化学方程式:S(g)+O2(g) SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是()
SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是()
| A.1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量 |
| B.1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
C.S(s)+O2(g) SO2(g) △H<-Q kJ·mol-1 SO2(g) △H<-Q kJ·mol-1 |
| D.1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ |
下列事实与氢键有关的是()
| A.水结成冰体积膨胀,密度变小 |
| B.水加热到很高的温度都难以分解 |
| C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |
已知1—18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是()
| A.四种元素位于同一周期 | B.氢化物的稳定性:H2Y>HZ |
| C.离子的氧化性:aW3+>bX+ | D.a+3=c-2 |