现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:甲: 、乙: 、F: 、H 、
(2)金属B既能与强酸又能与强碱反应,该金属B是: (填化学式)
金属C的最高价阳离子遇KSCN溶液呈血红色,该金属C是: (填化学式)
(3)反应③的化学方程式 。
(4)反应⑤的离子方程式 。
(一)写出下列有机物的系统命名或结构简式:
(1)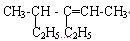 ______________________________
______________________________
(2)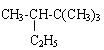
(3)CH3CH(CH3)C(CH3)2(CH2)2CH3
(4)2,5-二甲基-4-乙基庚烷(5) 2-甲基-2-戊烯
__________________________________________ ______________________________________
(二)按要求写出下列化学方程式:(请注明反应条件)
(1)甲苯 →TNT
;
(2)丙烯 → 聚丙烯
;
(3)实验室制备乙烯
;
(4) CaC2→乙炔
。
已知: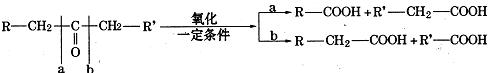
现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。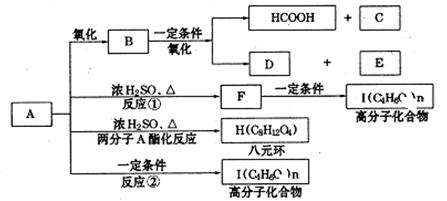
试回答下列问题:
(1)写出下列物质的结构简式:A,C,D;A中所含的官能团名称:。
(2)写出反应①和②的反应类型:反应①,反应②;
(3)写出下列变化的化学方程式:
①F→G:,
②A→H:。
下图是某些常见物质之间的转化关系。A、I是金属单质,F、G是非金属单质。已知B的相对分子质量在75~80之间,E是A的氧化物、其相对分子质量为232。请按要求填写下列空白: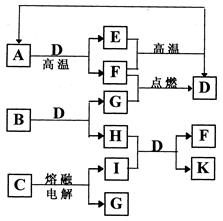
(1)A、B、C代表的物质分别是,,(填化学式)。
(2)写出B物质的电子式。
(3)K的水溶液呈碱性,用离子方程式说明其呈碱性的原因。
(4)写出I→K的离子方程式:。
(5)当有0.15molA完全反应时,反应中转移电子的物质的量为。
汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,可发生如下反应:2NO+2CO N2+2CO2。
N2+2CO2。
(1)2NO(g)+2CO(g) N2(g)+2CO2(g)反应的平衡常数的表达式为:
N2(g)+2CO2(g)反应的平衡常数的表达式为:
K=。
(2)已知:CO(g)+ O2(g)=2CO2(g)△H=一283 kJ/mol
O2(g)=2CO2(g)△H=一283 kJ/mol
N2(g)+O2(g)="2" NO(g)△H="+180" kJ/mol
则反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H=kJ/mol。
N2(g)+2CO2(g)△H=kJ/mol。
(3)对于可逆反应2NO(g)+2CO(g) N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是。
N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是。
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③在单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2和CO2的方向移动
(4)下列说法正确的是
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳 出行
出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(5)实验室可利用NaOH溶液吸收CO2,标准状况下2.24LCO2气体被1.5 L 0.1 mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成NaCO3的物质的量为mol。
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为。
(2)⑥和⑦的最高价含氧酸的酸性强弱为>。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式。
②写出检验A溶液中溶质的阴离子的方法。
③常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为mol。
④若上图中各步反应均为完全转化,则混合物x中含有的物质有。