根据碘与氢气反应的热化学方程式,下列判断正确的是
① I2(g)+H2(g) 2HI(g)△H=-9.48 kJ/mol
2HI(g)△H=-9.48 kJ/mol
② I2(s)+H2(g) 2HI(g)△H=+26.48 kJ/mol
2HI(g)△H=+26.48 kJ/mol
(1)写出固态碘生成气态碘的热化学方程式: 。
(2)若反应②吸收52.96kJ热量时,转移电子的物质的量是 mol。
(3)对于在恒温、恒容密闭容器中进行的反应①,能说明其达到化学平衡状态的是 。
A. 容器中气体压强不变
B. 容器中气体密度不变
C. 容器中气体颜色的深浅不变
D. 有n个H—H键断裂的同时有2n个H—I键断裂
(4)可通过反应2NO+O2=2NO2和NO2+2H++2I-=NO+I2+H2O来制取碘,NO在制碘过程中的作用是 。
(5)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如下图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液的蓝色消失时,立即关闭活塞A。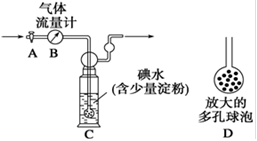
①用碘水测定SO2的含量的化学方程式是 。
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是 。
③洗气瓶C中溶液的蓝色消失后,没有及时关闭活塞A,测得的SO2含量_________(填“偏高”、“偏低”或“无影响”)。
2SO2(g) + O2(g) = 2SO3 (g)反应过程的能量变化如图所示。已知1mol SO2 (g)氧化为1mol SO3(g)的 ΔH= —99kJ·mol-1。请回答下列问题:
ΔH= —99kJ·mol-1。请回答下列问题:
 (1)图中A、C分别表示,E的大小对该反应的反应热
(1)图中A、C分别表示,E的大小对该反应的反应热
(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”或“降低”),△H(填“变大”、“变小”或“不变”), (2)图中△H=KJ·mol-1;
(2)图中△H=KJ·mol-1;
已知Cu+2H2 SO4(浓)= CuSO4 +2H2O + SO2↑,若有0.2molCu反应掉,则生成SO2的体积为:(标况下),有mol H2SO4发生还原反应。
①将一小块金属钠投入足量的MgSO4溶液中,现象是:
②用离子方程式解释以上现象:、;
③当金属钠着火时,应选用的灭火材料是
| A.干冰灭火剂 | B.水 | C.干燥沙土 | D.泡沫灭火器 |
(1)制印刷电路时常用氯化铁溶液作为“腐蚀液”。铜被氯化铁溶液腐蚀的方程式为:B2FeCl3+Cu=2FeCl2+CuCl2;氯化铁溶液也能与铁反应:2FeCl3+Fe=3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部可能出现的情况是(多选)
| A.有铜无铁 | B.有铁无铜 | C.有铁有铜 | D.无铁无铜 |
请把铜被氯化铁溶液腐蚀的化学方程式改写为离子方程式:
、
(2)某河道两旁有甲乙两厂。它们排放的工业废水中,共含有K+、Ag+、Fe3+、C1—、OH—、NO3—六种离子。若测得甲厂的废水明显呈碱性,则可推知乙厂废水中所含的三种离子是。
4分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S ="=" K2S+2NO2↑+CO2↑。在该反应中KNO3表现出性,被还原的元素是。