已知芳香族化合物B的分子式为C9H11Cl,2—甲基苯乙酸(E)是常用的一种有机合成中间体。存在下列转化关系: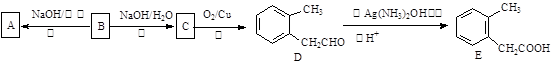
(1)B的结构简式为 。
(2)转化关系中B→A、B→C的反应类型依次为 、 。
(3)A的同分异构体F,苯环上有且仅有一个取代基,且能与溴水发生加成反应,任写一种符合条件F的结构简式 。
(4)据文献报道,该中间体E的另一合成工艺为
从反应原理分析,该工艺存在的明显不足为 ;
反应③的化学方程式为 。
下表中有九种物质,据表回答: (12分)
| 第I 组 |
第II 组 |
第III 组 |
|
| 甲 |
BaCl2 |
Fe |
Cu(NO3)2 |
| 乙 |
Fe2O3 |
K2SO4 |
H2SO4 |
| 丙 |
Zn |
Ba(OH)2 |
MgCl2 |
(1) 第III 组中有一种物质能与第组中的所有物质反应,这种物质是.
(2) 不跟第I 组中所有物质反应且能与第III 组中所有物质反应的第II 组中的物质是,其与硫酸反应的离子方程式为;
(1)镁称为“国防金属”,常用作还原剂和脱氧剂,二氧化碳常被用作灭火剂,但是当把点燃的镁条伸入盛有CO2的集气瓶中时,镁条却能继续燃烧。请写出化学方程式。
(2)下图变化是工业制硝酸的主要途径NH3→NO→NO2→HNO3请写出NH3→NO的化学方程式。硝酸生产过程排放出来的NO是大气污染物之一。目前有一种治理方法,是在400℃左右且有催化剂存在的情况下,用氨把NO还原成无色无毒气体直接排放到空气中,化学方程式为。
图为相互串联的甲、乙两电解池。
试回答:
(1)若甲电解池利用电解原理在铁上镀银,则A是 (填电极材料),电极反应式 ;B(要求同A)是 ,电极反应式 ,应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。C极附近呈 色。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是 mL。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol·L—1,溶液的pH等于 。
2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)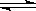 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图
试回答下列问题:
(1)800℃时。0—5min内,以B表示的平均反应速率为。
(2)能判断该反应达到化学平衡状态的标志是。
A.容器压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
E. 混合气体的平均分子量不再改变 F. 混合气体密度不变
G. A:B:C:D= 1:2:1:1
(3)利用图中数据计算800℃时的平衡常数K=,B的平衡转化率为:。该反应为反应(填吸热或放热)。
(4)800℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(A)=2.2mol,n(B)=5.2mol,n(C)=1.8mol,n(D)=1.8mol,则此时该反应
进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的中,然后再用蒸馏水稀释到所需的浓度。若用惰性电极电解AgNO3的水溶液,请写出电池反应的离子方程式
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32—水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1m2(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:
负极:
正极:;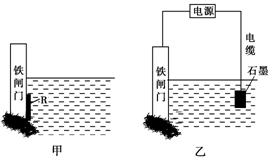
②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________。
| A.铜 | B.钠 | C.锌 | D.石墨 |
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2ml&url=http://static3.photo.sina.com.cn/orignal/515359c4g79a1c1001942&690
http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2ml&url=http://static3.photo.sina.com.cn/orignal/515359c4g79a1c1001942&690
①氢氧燃料电池的能量转化主要形式是,在导线中电子流动方向为(用a、b表示)。
②负极反应式为。
③电极表面镀铂粉的原因为。