关于图中各装置图的叙述错误的是
| A.装置①中,c为阳极,d为阴极 |
| B.装置②可用于收集H2、NH3、Cl2、HCl、NO2 |
| C.装置③中X为苯,可用于吸收氨气或氯化氢 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列有关说法正确的是
| A.NaI和NaIO3在一定条件下能反应生成I2 |
| B.I2在反应①中是还原产物,在反应②中是氧化产物 |
| C.两个反应中生成等量的I2时转移的电子数相等 |
D.氧化性:MnO2>IO >I2>SO >I2>SO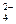 >Mn2+ >Mn2+ |
2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
| A.乙醇汽油是一种清洁能源,燃烧不会产生污染 |
| B.乙醇与汽油组成元素相同,化学成分相似 |
| C.乙醇汽油燃烧时,耗氧量高于等质量的汽油 |
| D.乙醇可通过淀粉转化制得,是一种可再生的燃料 |
小耘同学在复习单质、氧化物、酸、碱、盐性质时,构建了以下知识网络图,图中“—”表示相连两物质在一定条件下可以发生反应,“→”表示两物质在一定条件下可以转化。下面四组选项中,按照甲、乙、丙、丁的顺序且符合下图要求的是()
| A.O2COCuOC |
| B.AgNO3MgCl2NaOHH2SO4 |
| C.CaCl2 K2CO3NaCl KOH |
| D.K2CO3CuSO4KOHHNO3 |
可以判断油脂皂化反应基本完成的现象是 ()
| A.反应液使红色石蕊试纸变蓝色 | B.反应液使蓝色石蕊试纸变红色 |
| C.反应后静置,反应液分为两层 | D.反应后静置,反应液不分层 |