将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则下列说法正确的是
| A.当加氢氧化钠溶液体积为20mL时,溶液的pH值等于7 |
| B.当加氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝 |
| C.NaOH溶液的物质的量浓度为5 mol/L |
| D.生成的H2在标准状况下的体积为11.2 L |
下列装置所示的实验不能达到目的的是()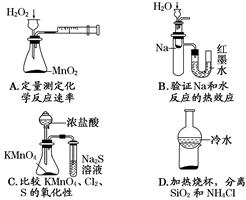
某同学为探究SO2与Ba2+只有在碱性条件下才能形成BaSO3沉淀,设计了如下方案,你认为可行的是()
| A.将SO2通入Ba(OH)2溶液中观察有白色沉淀生成 |
| B.将SO2通入Ba(NO3)2溶液中观察有白色沉淀生成 |
| C.将SO2分别通入BaCl2溶液、BaCl2与HCl的混合溶液、Ba(OH)2溶液中,观察到只有Ba(OH)2中有白色沉淀生成 |
| D.将SO2通入BaCl2与NH3的混合溶液中有白色沉淀生成 |
下列关于实验的叙述正确的是()
| A.向过量稀硫酸中加入除去油污的废铁屑,是制备硫酸亚铁的可行方案 |
| B.向碳酸钠粉末中加入少量乙酸溶液,生成大量气泡,说明乙酸的酸性比碳酸强 |
| C.向铝屑与硫酸反应后的溶液中加入氢氧化钠溶液反应,是制备氢氧化铝的最佳方案 |
| D.向硫酸亚铁铵溶液中,依次加入氯水和硫氰化钾溶液,溶液变红,说明溶液中含有Fe2+ |
由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是()
A.Mg Mg(NO3)2 Mg(NO3)2 |
B.Mg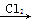 MgCl2 MgCl2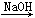 Mg(OH)2 Mg(OH)2 Mg(NO3)2 Mg(NO3)2 |
C.Mg MgO MgO Mg(NO3)2 Mg(NO3)2 |
D.Mg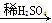 MgSO4 MgSO4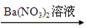 Mg(NO3)2 Mg(NO3)2 |
关于下列各实验装置的叙述中,错误的是()
| A.装置①可用于分离C2H5OH和H2O的混合物 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| D.装置④可用于干燥、收集NH3,并吸收多余的NH3 |