(16分)我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
请根据以上信息回答下列问题:
I.(1)写出N的化学式和B的名称:N 、B 。
(2)写出反应②的化学方程式,并标出其电子转移的方向和数目:
(3)写出反应③的离子方程式: ,
Ⅱ.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为 。
A. ②③④① B. ③④②① C. ④③②① D. ③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是 。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是 。
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁 单质处循环
单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有 性。
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适? (填“甲”或“乙”),理由是 。
(填“甲”或“乙”),理由是 。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。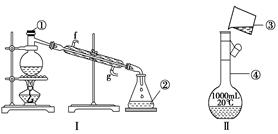
(1)写出下列仪器的名称:①________,②________,④__________。
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有______________,将仪器补充完整后进行的实验操作的名称为________;冷凝管的进水口是________(填“f”或“g”);现需配制250 mL 0.2 mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误是_____________。
(14分)为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。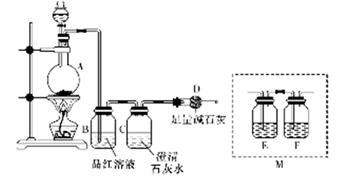
往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯。
(1)装置B的作用是______________________________________。
(2)甲同学观察到装置C中有白色沉淀生成。他得出了使澄清石灰水变浑浊的气体是二氧化碳的结论。装置A中能产生二氧化碳的化学方程式为_______________。
(3)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B~C之间添加装置M,装置E、F中盛放的试剂分别是_____、__________。重新实验后观察到装置F中的现象是__________。
(4)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。测定铁元素质量分数的实验步骤如下;
I.往烧瓶A中加入过量的还原剂铜粉使溶液中的Fe3+完全转化为Fe2+过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL。
①步骤II中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是___________________。
②滴定过程中_______________(填“需要”或“不需要")加入指示剂。
③铁碳合金中铁元素的质最分数为_____________________________。
(本小题8分)100 mL硝酸和硫酸的混合溶液中,加入50mL 4 mol·L-1的NaOH溶液,恰好完全中和,然后再向反应后的混合溶液中加入足量BaCl2溶液,可得到得沉淀11.65g求:
⑴原混合溶液中H+的物质的量浓度。
⑵原混合溶液中所含HNO3的质量为多少?
(14分) 实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取质量分数为36.5%浓盐酸体积________mL,除250mL容量瓶外还需要的其它仪器___________________________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________________.
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为_____________________________________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作___________ ;b.加蒸馏水时不慎超过了刻度______________ ;c.定容时俯视________________。
(1)写出下图中序号①~④仪器的名称:
①;②;③;④;(填仪器序号)
(3)分离碘水中的碘应先选择装置(填装置序号)进行 和操作 ,再用装置(填装置序号)进行操作。
(4)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5 mol/L的稀硫酸100mL。
①所需仪器除烧杯、玻璃棒外还需 __________、 __________、 __________。
②所取浓硫酸的体积为____________mL。
③下列操作引起所配溶液浓度偏高的是
A.取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D定容时俯视
E颠倒摇匀后发现液面低于刻度线,但未加水至刻度线