蛋壳的主要成分是CaCO3,其次是SiO2、MgCO3及色素等杂质,测定蛋壳中钙的含量时常涉及如图操作步骤,其中最后滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。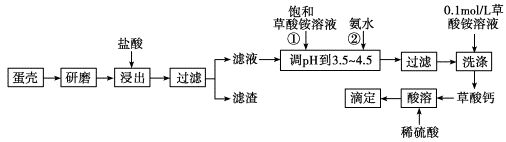
资料支持:①草酸的电离方程式为H2C2O4 H++HC2O ;
②滴定过程的反应为H2C2O4+MnO +H+―→Mn2++CO2↑+H2O(未配平);
③Ksp(CaC2O4)=2.510-9,Ksp(MgC2O4)=8.610-5
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________;
(3)实验中通常用0.1 molL-1草酸铵溶液洗涤沉淀。若实验时用水洗涤沉淀,且每次洗涤时消耗草酸铵溶液和水的体积相同,则每次洗涤时用草酸铵溶液洗涤与用水洗涤损失的质量之比为____________;
(4)达到滴定终点的特征为;
(5)若考虑MgCO3的存在,则此法求得的钙含量略__________实际值(填>、=、<)
实验室用图I所示的装置制取干燥的氨气。
(1)A处反应的化学方程式为。
(2)为收集到干燥的氨气,导管C应接(填序号)。
(3)装置B中盛装的试剂的名称是。
(4)在水槽中加入水(含酚酞),将充满氨气的试管倒置于放入水槽中(如图Ⅱ所示),将拇指稍移开试管口,可观察到的现象为_______________。
(5)在D、E、F三种气体收集方法中,能用于收集NO的是________(填写序号)。
某无色待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等阳离子。某同学进行如下实验:
I.加入过量的稀盐酸,有白色沉淀生成。
II.过滤,取少许滤液,向其中加入过量的稀硫酸,又有白色沉淀生成。
III.另取少量步骤II中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
(1)待测液中一定含有的离子是__________,一定不含有的离子是___________。
(2)步骤III中产生气体的离子方程式为__________________。
现有一未配平的氧化还原反应:
KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X
(1)该反应的还原剂是_________。
(2)已知0.2 mol KClO3在反应中得到1 mol电子生成X,则X的化学式是__________。
(3)根据上述反应可推知__________________(填写序号)。
| A.氧化性:KClO3>H3PO4 | B.氧化性:H3PO4>KClO3 |
| C.还原性:PH3>X | D.还原性:X>PH3 |
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)FeCl3溶液与金属铜发生反应的离子方程式是。
(2)检验溶液中Fe3+存在的操作步骤和现象是。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,准备采用下列步骤:
上述实验中加入或生成的有关物质的化学式为②④____________
通入⑥得到FeCl3溶液的离子反应方程式为________________。
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质___________(填序号,下同);
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
②将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________。
A.S2— B.SC.SO32—D.SO42—
(2)从物质分类的角度可以推测物质的性质。现有由MgO、Al2O3、Fe2O3、SiO2组成的某混合物试样。
①其中Al2O3属于_______氧化物,MgO和Fe2O3属于_________氧化物(填“酸性”、“碱性”或“两性”);
②将试样溶于过量的盐酸中,过滤,滤渣的主要成分是_________;再向滤液中加入NaOH溶液至过量,过滤,滤渣中的主要成分是_________;
③若将该试样直接溶于过量的NaOH溶液中,所发生的反应的化学方程式是______________________(可任意写其中一个)。