能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(I)十3O2(g) 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol—1
②H2O(I) ="==" H2O(g) △H="+" 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 (2分).
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H1________0(填“>”、“<”或“=”)。
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是 。
| A.升高温度 | B.增加CO2的量 |
| C.充入He,使体系总压强增大 | D.按原比例再充入CO2和H2 |
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) ="0.5" mol·L—1,,则该温度下该反应的平衡常数为 。
④.某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为______________________
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1∶1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。,则该反应的化学方程式为________。(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则
溶液中c(Na+)+c(H+)_____ c(NO3-)+c(OH-)(填写“>”“=”或“<”)
在一只小烧杯里,加入20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4+Cl晶体,并用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是(该空2分)
(2)写出有关反应的化学方程式:(该空2分,余下各空1分)
该反应属反应(填基本反应类型)。
(3)实验中观察到的现象有、 且反应混合物成糊状,反应混合物呈糊状的原因是。
(4)通过现象,说明该反应为热反应,这是由于反应物的总能量生成物的总能量。
在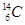 、
、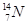 、
、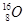 、
、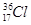 、
、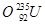 、
、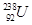 中;
中;
(1)和互为同位素
(2)和的质量数相等,但不能互称为同位素
(3)和的中子数相等,但质子数不相等,所以不是同一种元素.
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X、Y、Z、W
(2)由以上元素中的两种元素组成的能溶于水且水溶液弱显碱性的化合物的电子式为。
(3)由X、Y、Z所形成的离子化合物是,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是。
下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①,⑥,⑦。
(2)画出原子的结构示意图:④,⑤,⑧。
(3)在这些元素中,最活泼的金属元素是,最活泼的非金属元素是,最不活泼的元素是。(均填元素符号)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是,碱性最强的是,呈两性的氢氧化物是。
(5)在③与④中,化学性质较活泼的是(填元素符号),怎样用化学实验证明:
答:(该空2分,其余每空1分)
(1)写出下列基团(或官能团)的名称或结构简式:
-CH2CH3、-OH、异丙基:、
醛基、羧基、 —COOR。
(2) (8分) ①0. 1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.2 mol,则该烃的分子式为。结构简式为。
②某烷烃的分子量为 72,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式为,名称为。
(3)按要求表示下列有机物:
(1)按系统命名法命名.
有机物 的名称是 。
的名称是 。
(2)写出下列各种有机物的结构简式
①2,3-二甲基-4-乙基已烷 。
②支链只有一个乙基且相对分子质量最小的烷烃。
③异戊烷(写出键线式)。