有一无色透明溶液,,可能含有Na+、K+、Fe2+、Ba2+、NO3-、SO32-、SO42-离子中的若干种,依次进行下列实验,观察到的现象如下。
①取少量该溶液,滴加氯水,氯水褪色。
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热, 有无色气体产生,后在空气中又变成红棕色
③用洁净的铂丝蘸取该溶液,在酒精灯火焰上灼烧,火焰呈黄色
④取少量该溶液,加入足量BaCl2溶液,产生白色沉淀,再加足量稀硝酸,沉淀不溶解。
根据上述实验现象判断:
(1)溶液中肯定存在的离子是 。
(2)溶液中可能存在的离子是 。
(3)为进一步确定可能存在的离子,应该补充的实验是 。
下图为物质A~I的转化关系(部分反应物、生成物没有列出)。其中B为某金属矿的主要成分,经过一系列反应可得到E和F。D、E常温下为气体,D、F为常见单质,单质F可与H的浓溶液加热时发生反应。
请回答下列问题:
(1)写出G的化学式:________________。
(2)反应①的离子方程式为__________________。
(3)单质F与H的浓溶液发生反应的化学方程式为______________________。
(4)用Pt作电极电解I溶液,完全电解后的电解质溶液是_______________,其阳极的电极反应式为____________________。
(5)已知每16gE与D完全反应,放出24.75 kJ热量,则反应②的热化学方程式为
________________________________________________.
(6)工业制备G时,混合气体的组成中E占7%、D占11%,现有100体积混合气体进入反应装置,导出的气体恢复到原温度和压强后变为97.2体积。则E的转化率为________.
某同学利用铁与水蒸气反应后的固体物质进行了如下实验: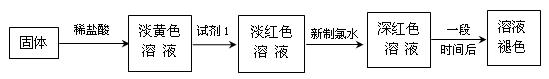
(1)固体溶于稀盐酸的化学方程式为;
(2)试剂1的化学式是;加入试剂1后呈红色的原因是(用离子方程式表示):。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示);
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?
| 编 号 |
猜想 |
| 甲 |
溶液中的+3价Fe又被还原为+2价Fe |
| 乙 |
溶液中的SCN-被过量的氯水氧化 |
| 丙 |
新制的氯水具有漂白性,将该溶液漂白 |
| 丁 |
? |
为验证乙同学的猜想合理与否?请同学们根据结论完成下表的实验设计方案。可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0 mol·L-1 NaOH、0.1mol·L-1FeCl3、0.1mol·L-1CuSO4、20%KSCN、蒸馏水。
| 实验操作 |
预期现象 |
结 论 |
| 说明乙同学的猜想是合理的 |
铜陵有色金属集团公司是电解铜产量全国第一的大型企业。其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程: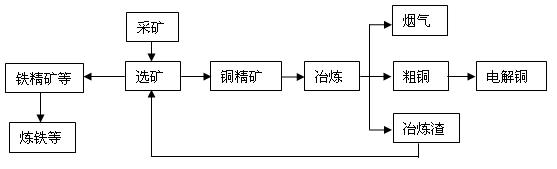
冶炼中的主要反应: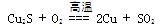
⑴烟气中的主要废气是,从提高资源利用率和减排考虑,其综合利用方式是:。
⑵电解法精炼铜时,阳极是(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式沉淀在电解槽(填“阳极”或“阴极”)的槽底,阴极的电极反应式是。
⑶在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(Ksp)
| 物 质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
| Ksp |
8.0×10-16 |
4.0×10-38 |
3.0×10-17 |
2.2×10-20 |
①调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是。
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是
。加入H2O2后发生反应的离子方程式为。
由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙醇的技术流程: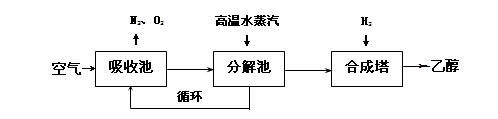
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇。回答下列问题:
(1)写出吸收池中反应的离子方程式。
(2)从分解池中循环使用的物质是。
(3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g)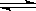 CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
写出该反应的化学平衡常数表达式 K=。
(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是使原料有较大的转化率 ,由CO2制取CH3CH2OH的优点是。(写出一点即可)
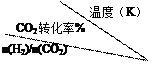 |
500 |
600 |
700 |
800 |
| 1.5 |
45 |
33 |
20 |
12 |
| 2.0 |
60 |
43 |
28 |
15 |
| 3.0 |
83 |
62 |
37 |
22 |
(5)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:
根据表中数据分析:
①温度升高,该反应的平衡常数K值(选填“增大”、“减小”或“不变”);
②提高氢碳n(H2)/n(CO2)比,对生成乙醇(选填“不利”、“有利”或“无影响”)。
丁子香酚结构简式如图: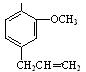 。 丁子香酚的一种同分异构体:
。 丁子香酚的一种同分异构体:
对—甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体。某校兴趣小组提出可以利用中学所学的简单有机物进行合成,A的产量标志着一个国家石油化工发展水平。其方案如下: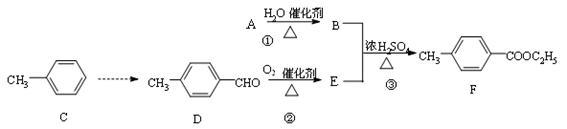
(1)写出丁子香酚的分子式含有官能团的名称。
(2)指出化学反应类型:①;②。
(3)下列物质不能与丁子香酚发生反应的是(填序号)。
a.NaOH溶液 b.NaHCO3溶液 c.Br2的四氯化碳溶液 d.乙醇
(4)写出反应③的化学反应方程式:。
(5)写出符合①含有苯环;②能够发生银镜反应的D的同分异构体:。(只答对一种即可)