以下是某研究小组探究影响反应速率部分因素的相关实验数据。
| 实验序号 |
H2O2溶 液浓度% |
H2O2溶液体积/mL |
温度℃ |
MnO2的用量/g |
收集氧气的体积/mL |
反应所需 的时间/s |
| ① |
5 |
1 |
20 |
0.1 |
4 |
16.75 |
| ② |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
| ③ |
30 |
5 |
35 |
|
2 |
49.21 |
| ④ |
30 |
5 |
55 |
|
2 |
10.76 |
(1)通过实验①和②对比可知,化学反应速率与 有关;从实验 和 对比可知,化学反应速率与温度的关系是: ;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:
。
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量 (选填“减小”或“不变”或“增大”)。
某同学设计如下实验装置探究“分子的性质实验”
图I是按课本进行的一个化学实验,大烧杯中的实验现象是___________,此实验说明分子______________________。但是在实验时同学们闻到了一股难闻的刺激性气味,于是小明对原实验装置进行了改进,装置如图Ⅱ,并进行如下操作: a. 向B、C、E三支试管中分别加入5 mL的蒸馏水,各滴入1~2滴无色酚酞溶液,振荡,观察溶液颜色。
b. 在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察几分钟。
【分析讨论】(1)E试管放有酚酞溶液的目的是___________。
(2)由此可以得到的实验结论是:①___________,②___________。
(3)对比改进前的实验,改进后实验的优点是___________
甲同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬的。她想到在学过的金属活 动性顺序中并没有金属铬,为比较铬与常见金属铁、铜的活动性强弱,她和同学们在应用所学知识进行分析的基础上,提出了以下猜想,并进行了实验探究。
动性顺序中并没有金属铬,为比较铬与常见金属铁、铜的活动性强弱,她和同学们在应用所学知识进行分析的基础上,提出了以下猜想,并进行了实验探究。
【作出猜想】
猜想1. Cr>Fe>Cu;  猜想2. Fe>Cu >Cr;猜想3.你的猜想是。
猜想2. Fe>Cu >Cr;猜想3.你的猜想是。
【查阅资料】
①铬(Cr)是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【实验药品】
铁片、铬片、铜片、稀硫酸、CuSO4溶液、CrSO4溶液、FeSO4溶液。(溶液均为新制)
【甲同学实验】甲同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的稀硫酸。
| 实验 |
实验操作 |
实验现象 |
结论与解释 |
| 试管1 |
  |
铁片表面产生气泡较慢,溶液变为浅绿色。 |
(1)实验前用砂纸打磨金属片的目的是。 (2)甲同学得到的结论是猜想正确。 |
| 试管2 |
  |
铬片表面产生气泡较快,溶液变为蓝色。 |
|
| 试管3 |
  |
。 |
【乙同学实验】乙同学为验证甲同学的结论,又设计了以下实验。
| 实验 |
实验操作 |
实验现象 |
结论与解释 |
| 试管4 |
  |
(1)甲同学的结论正确。 (2)请写出铬与硫酸铜反应的化学方程式。 |
|
| 试管5 |
  |
【实验反思】
(1)你认为乙同学没有必要做的实验是。
(2)请你结合所给的实验药品再设计一个实验,验证甲同学的结论。
| 实验操作和实验现象 |
结论与解释 |
| 。 |
甲同学的结论正确。 |
燃烧是一种发光、放热的剧烈的化学反应。认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
[查阅资料]物质燃烧一般需要同时满足三个条件,物质具有可燃性是燃烧的首要条件,发生燃烧的另外两个条件分别是__________________;______________。
[实验目的]验证木炭发生燃烧的另外两个条件中,缺少任何一个条件都不能燃烧(两个条件须分别验证)。
[实验设计与操作]下面是验证燃烧条件的实验装置图(可通过开启、关闭活塞控制液体)。

在完成气密性检查后加入药品,并已设法在整个装置中充满了氮气。若要求实验过程中不得拆、装仪器,请设计后续的实验步骤,并按要求填表。
| 步骤 |
操作 |
预计现象及得出的结论 |
| ① |
在活塞关闭的状态下,点燃酒精灯加热 |
|
| ② |
盖灭酒精灯,待仪器恢复到常温 |
 |
| ③ |
||
| ④ |
[反思评价]实验过程中,装置B的作用可能是。
对实验装置的改进与创新,能够提高学习化学 的兴趣和能力。某兴趣小组同学进行了以下实验设计(注:图中部分固定装置省略,a为活塞,b为支管口。由分液漏斗滴入内置试管的液体量如图所示)。
的兴趣和能力。某兴趣小组同学进行了以下实验设计(注:图中部分固定装置省略,a为活塞,b为支管口。由分液漏斗滴入内置试管的液体量如图所示)。
⑴ 甲同学设计了如图1所示装置。向内置试管中滴入足量浓氨水,一段时间后,观察到酚酞溶液变为红色,此现象说明分子具有的性质是。
⑵ 乙同学设计了如图2所示装置。向内置试管中滴入足量稀硫酸,与碳酸钠充分反应,化学方程式为:H2SO4 + Na2CO3 ="=" Na2SO4 + H2O + CO2↑。
①通过仔细观察,可看到两条试纸出现的相同现象是,不同现象是。
②将燃着的木条放在支管口处,可观察到的现象是。
③综合分析①和②现象,能够总结出二氧化碳的性质有。
⑶ 丙同学设计了如图3所示装置。向内置试管中滴入足量溶液A,一段时间后,观察到水中锌粒表面有气泡,出现该现象的原因可能是。
亚硝酸钠(NaNO2)是一种外观极像食盐,且具有与食盐一样咸味的有毒物质,因此,这种工业盐常被冒充食盐掺假或被误作食盐使用,导致多起中毒事故发生。某校化学实验室有一瓶标签破损的试剂瓶,盛放的药品可能是氯化钠固体,也可能是亚硝酸钠固体,该校化学小组同学通过实验手段确定该瓶盛放的药品的成分。
其主要探究过程如下:
【提出假设】该药品的成分是NaCl。
【查阅资料】
| 亚硝酸钠 |
氯化钠 |
|
| 溶解性 |
15℃时溶解度为81.5g |
15℃时溶解度为35.8g |
| 熔点 |
271℃ |
801℃ |
| 沸点 |
320℃时发生分解有氧气等气体产生 |
1413℃ |
【实验过程】化学小组同学根据自己的假设,设计实验验证。请你帮助他们完成实验报告。
(1)小华同学设计的实验如下:
| 实验装置 |
实验主要过程 |
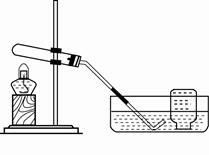 |
①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到,松开手后,导管口有液面上升。 ②加入药品,加热,导管口有大量气泡生成。 ③收集气体。 ④停止加热。熄灭酒精灯前,应,目的是。 |
(2)小明同学根据小华的实验判断该药品的成分是。他又结合两物质的溶解性知识,设计了另一种实验方案,得到了同样的结论。其实验方案是。