(10分)
1:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%一30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。
Ⅱ:探究家庭制备次氯酸钠溶液的发生器如图,原理是用石墨做电极电解饱和食盐水。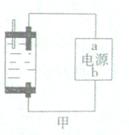
(1)若通电后,为使氯气被全部吸收,则电源的a极的名称是 。
(2)电解饱和食盐水的离子方程式为 ,所得的次氯酸钠溶液中加入几滴石蕊试液,观察到的现象是 ,用离子方程式和简要文字说明理由 。
欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加蒸馏水至刻度线 |
| D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好.
(4)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_________________________。
(5)在配制过程中,①某学生观察定容时仰视液面,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”下同)。②未经冷却趁热将溶液注入容量瓶中,________。③摇匀后发现液面低于刻度线再加水,________。④容量瓶中原有少量蒸馏水,________。
怎样用化学方法除去下列物质中混有的少量杂质(用有关反应的离子方程式)。
(1)铜粉中混有铁粉
(2)NaHCO3溶液中混有Na2CO3
(3)FeCl2溶液中混有CuCl2
在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 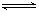 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: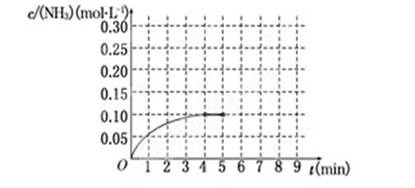
(1)根据上图,计算从反应开始到平衡时,平衡反应速率v(NH3)为__________.
(2)该反应达到平衡时H2的转化率为________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________.(填序号)
a.0.20 mol·L-1b.0.12 mol·L-1
c.0.10 mol·L-1d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式_________,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1K2(填“>”“="”" 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则25℃时水的电离平衡曲线应为__________(填“A”或“B”),请说明理由。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为__________________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
曲线B对应温度下,pH=2的HCl溶液和pH=10的某BOH溶液等体积混合后,混合溶液的pH=8。请分析其原因:。
化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0。反应物A的浓度(mol·L-1)随时间(min)的变化情况如下表:
| 实验序号 |
温度 |
0 min |
10 min |
20 min |
30min |
40min |
50 min |
60min |
| 1 |
800℃ |
1.0 |
0.8 |
0.67 |
0.57 |
0.5 |
0.5 |
0.5 |
| 2 |
800℃ |
c2 |
0.6 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.6 |
0.6 |
0.6 |
| 4 |
820℃ |
1.0 |
0.4 |
0.25 |
02 |
0.2 |
02 |
02 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10min至20min时间内v(A)的平均速率为mol·L-1·min-l
(2)在实验2中A的初始浓度为mol·L-1,由实验2的数据,可推测实验2中还隐含的条件是。
(3)设实验3的反应速率为v3,实验1的反应速率为vl,则v3 (填“>”、“<”或“="”)" vl。且c3(填“>”、“<”或“="”)1.0" mol·L-1。
(4)比较实验4和实验1,可推测该反应是(填“吸热”或“放热”)反应,