某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_________
(填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视 _______________________________判断到达滴定终点的依据是:__________________________________________________。
(4)以下是实验数据记录表
| 滴定次数 |
盐酸体积(mL) |
NaOH溶液体积读数(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.00 |
18.10 |
| 2 |
20.00 |
0.00 |
16.30 |
| 3 |
20.00 |
0.00 |
16.22 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是( )
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5) 根据上表记录数据,通过计算可得,该盐酸浓度为:____________mol·L-1
某实验小组查阅资料得知:
5C2O42—+2MnO4—+16H+====10CO2↑+2Mn2++8H2O
欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。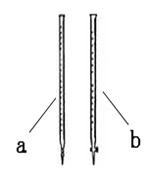
(1)滴定时用______(填a或b)。
(2)滴定管盛装KMnO4标准溶液。滴定前______(填“是”或“否”)滴加指示剂,滴定终点的现象是____________________。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为______________。
下面是关于药物“华素片(西地碘片)”使用说明书中的部分内容:
华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片,是将碘利用分子分散技术制成分子态西地碘,并加入适量薄荷脑等。
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是________(写分子式);
②请推断华素片________(“是”或“不是”)白色。
(2)某学生为验证华素片中确定含有上述活性成分,完成实验如下,请填写:
①取一粒药片放入研钵中研碎,将药粉装入试管中,并加入约2 mL蒸馏水;再向该试管中加入约2 mL________(填编号),并用力振荡。
| A.酒精 | B.NaOH溶液 |
| C.四氯化碳 | D.盐酸 |
②描述加入该液体后可能观察到的现象
________________________________________________________________________。
③选用该液体做实验的原因是
________________________________________________________________________。
(3)请再设计另一种方法,验证华素片中的活性成分(注意叙述操作方法和实验结论)________________________________________________________________________
________________________________________________________________________。
在某澄清溶液中,可能存在下述几种离子:H+、K+、Ba2+、SO42—、I—、CO32—。取该溶液进行下述实验:
①用pH试纸检验,该溶液呈强酸性;
②取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳层呈紫色;
③另取部分溶液,逐滴加入NaOH溶液,使溶液由酸性逐渐呈碱性,然后再加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,推断原溶液中:
(1)肯定存在的离子是,
(2)肯定不存在的离子是。
(3)可能存在的离子是。
(4)写出步骤②中发生反应的离子方程式。
Ⅰ 某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。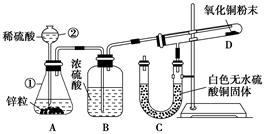
(1)写出编号仪器的名称:①________ ②________。
(2)浓硫酸的作用是____________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1mol水分子,转移的电子数为________个。
Ⅱ 实验时他需要1.0mol/L的硫酸溶液250mL。根据溶液的配制回答下列问题。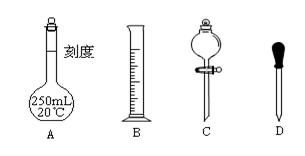
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀。
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL,如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是___________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量_________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式______________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是_______________________________
___________________________________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。