下列各表述与示意图一致的是
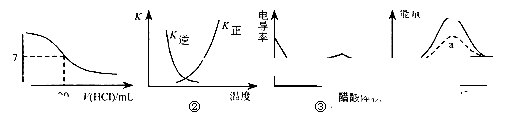
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 KOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应N2(g)+3H2(g)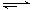 2NH3(g) ΔH < 0正、逆反应的平衡常数K随温度的变化 2NH3(g) ΔH < 0正、逆反应的平衡常数K随温度的变化 |
| C.图③表示醋酸溶液滴定NaOH和氨水混合溶液的电导率曲线 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g) → CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
分子式为C5H12O 且属于醇的同分异构体共有(不考虑立体异构)
| A.6种 | B.7种 | C.8种 | D.9种 |
2,4-二甲基戊烷的一氯代物有
| A.2种 | B.3种 | C.4种 | D.5种 |
某有机化合物的结构如图,关于该化合物的下列说法正确的是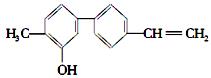
| A.由于含有氧元素不是有机物 | B.该物质的分子式是 C15H14O |
| C.分子中含有羟基属于醇 | D.分子中有三种官能团 |
海水提镁的主要流程如下: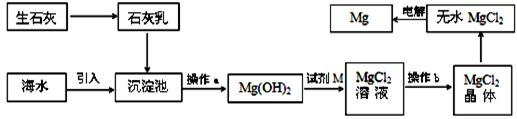
下列说法正确的是
①试剂M是盐酸
②流程中的反应全部都是非氧化还原反应
③操作b只是过滤
④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤电解熔融MgCl2比电解熔融的MgO制金属镁更节约能量
| A.①②③④⑤ | B.②③ | C.④⑤ | D.①④⑤ |
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) 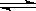 1/2N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
1/2N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |