(10广东省19)2010年春节联欢晚会上,刘谦的魔术表演激起了人们强烈的好奇心,并在全国范围内掀起了魔术表演的热潮。在学校科技节活动中,一位九年级同学给低年级同学表演了一组化学小魔术,请你利用所学化学知识揭开其中之谜。
魔术一“奇花变色”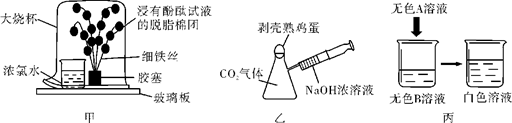
道具如图甲所示,该魔术可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为 色。该魔术中没有涉及的性质是 (填字母序号)。
A.氨分子是不断运动的 B.氨分子有一定质量
C.浓氨水具有挥发性 D.氨气的水溶液显碱性
魔术二“瓶吞鸡蛋”
道具如图乙所示,将注射器中NaOH浓溶液注入瓶中,片刻后会看到鸡蛋被“吞”入瓶中。该魔术中涉及的化学反应为________________(用化学方程式表示)。
魔术三 “‘清水’变‘牛奶’”
道具如图丙所示,当A溶液加到烧杯中,无色溶液变成白色浊液。若A为酸溶液,则A、B的可能组合:A为 ;B为 (答案合理即可)。(只需写一组)
把一条用导热性能良好的粗金属丝(如铜丝、铝丝)绕成的线圈罩在一枝燃烧的蜡烛的火焰上,蜡烛的火焰很快就熄灭了。如果预先把金属丝圈加热,再罩到蜡烛火焰上,蜡烛就可以照常燃烧。怎样解释这种现象?
实验室用过氧化氢(H2O2)俗称双氧水慢慢加入装有少量二氧化锰粉末的锥形瓶中,可用如图3装置用双氧水制取氧气(通过分液漏斗玻璃活塞的“开”、“关”,可随时向锥形瓶中滴加双氧水)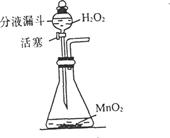
⑴试写出该反应的表达式
⑵如果在实验室中用此法代替高锰的钾加热制取氧气请简述其优点有哪些?(任意答两点)
⑶二氧化锰在这个实验中所起的作用是
检验所收集的气体是氧气的方法是
学生为验证空气中氧气的体积分数,进行如下实验(如图)燃烧匙里盛着足量的硫,反应结束,冷却后,打开C夹,水不沿导管进入A瓶。请回答:
⑴B容器的名称是 ,硫在A瓶中燃烧的文字表达式是
⑵该实验失败的主要原因是
⑶若不改变原装置,要使实验成功,你的改进意见是:
⑷若实验成功,进入A瓶里的水约可达到A瓶容积的 ,由此可证明空气中氧气的体积分数约为 。
小明同学打算自己探究一下MnO2在分解过氧化氢时所起的作用,但手边没有现成的MnO2药品,只有高锰酸钾,30%过氧化氢溶液、木条、水、火柴,其它仪器可任选。
(1)若要先得到MnO2粉末,反应原理是(用化学式表示化学反应)
(2)已知实验(1)中试管中剩下两种物质,其中二氧化锰难溶于水,而另一种易溶于水,小明用了一种方法将它们分离开来,步骤为:① ,② 。
(3)小明认为若要探究MnO2在较低的温度下对分解H2O2有无催化作用,需作对比实验,他设计了三组实验:①在试管中加入5ml 30%的过氧化氢溶液,把带火星的木条伸入试管,看木条是否复燃。②...;③在第3支试管中加入5ml 30%过氧化氢溶液,并加入少量二氧化锰,把带火星的木条伸入试管,观察木条是否复燃。
你认为小明设计的第2组实验过程为:。
(4)小明得到的是③中有O2放出,但他认为③中有O2放出是因为MnO2与H2O2发生了反应,你如何帮他设计实验来说明MnO2没有和H2O2起反应,而只是起了催化作用?
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,化学兴趣小组设计了如右图所示的实验,其中A、C是包有过氧化钠的棉花,B是未包过氧化钠的棉花。实验中观察到A、C棉花依次燃烧,B棉花未燃烧。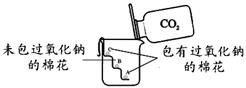
(1)B棉花起的作用是_________________。
(2)棉花能燃烧,除了满足棉花是可燃物之外,还需满足_____________________的条件。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.Na2O2与稀盐酸反应时,生成NaCl、H2O和O2。
2.在常温下Na2O2与CO2、H2O均能发生化学反应。
3.无水硫酸铜为白色固体,吸水后变为蓝色。
【实验设计】经过讨论,小组同学设计用下图所示装置进行实验探究。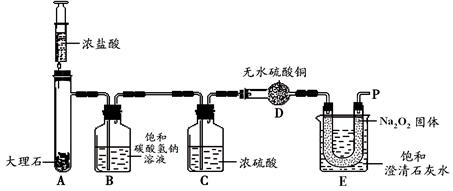
【实验步骤】①检查整套装置的气密性;
②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的木条,观察现象。
【实验现象】①无水硫酸铜没有变蓝色;
②___________________________________;
③___________________________________。
【实验分析】
(3)B装置的作用是______________________。
(4)D装置中产生现象的原因是。
【实验结论】①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为 同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式 。