(10,威海12)有三种失去标签的溶质质量分数分别为15%、l0%和5%的盐酸溶液。限定你选择下列仪器和药品,设计两种不局的实验方案,辨别出最浓的和最稀的盐酸溶液。
实验仪器:精密温度计、剪刀、镊子、量筒、秒表、烧杯、大试管、胶头滴管。
药 品:镁条
提 示:①镁条和盐酸反应速度很快,通过观察放出气泡速度很难准确判断盐酸浓度的大小,所以不建议用这种方法辨别之。②当你设计一种方案时,不必用到所有的仪器。③在描述每种实验方案时,要求说明:观察或测定何种变量、需要控制的条件、选用的仪器、实验步骤及结果与推论。
(1)实验知识和技能准备:
用量筒量取一定体积的液体时,正确的操作方法是___________________________________________
______________________________________________________________________________________________________________________________________________________________________________________
向试管中加入块状固体药品的方法是_______________________________________________________
___________________________________________________________________________________________
(2)把你设计的实验方案依次填写在下表中.
实验方案一:
| 你观察或 测定的量 |
需要控制 的实验条件 |
选用的 仪器 |
实验步骤 |
结果与推论 |
| |
|
|
|
|
实验方案二:
| 你观察或 测定的量 |
需要控制 的实验条件 |
选用的 仪器 |
实验步骤 |
结果与推论 |
| |
|
|
|
|
(3)为了排除实验过程中偶然因素的干扰,保证实验结果的可靠性,你认为还应该如何完善你的实验方案?
___________________________________________________________________________________________
铁矿石冶炼成铁是一个复杂的过程,把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。一氧化碳还原氧化铁的化学方程式为①。某化学兴趣小组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。
【提出问题】单质碳也具有还原性,碳还原氧化铁的化学方程式为②。为什么工业上不用焦炭作为还原剂直接还原铁矿石?
【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。
【进行实验】实验步骤及注意事项如下:
①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入下图装置A的试管中;另一份放入下图装置B的玻璃管中。
②装置A和B两组实验同时开始进行。在装置B的反应中,实验开始前应先③(选填“通CO”或“加热”); 实验结束后应继续通入CO直至冷却至室温,其原因是④。
【实验现象】当装置B的玻璃管中固体完全由⑤时(选填“红色变为黑色”或“黑色变为红色”),装置A的试管中仍有⑥。
【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。
【交流与反思】经过查阅资料和讨论,该小组同学发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个:⑦。
【完善实验】联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过下图的检验装置,正确的连接顺序是⑧(选填字母,装置可重复使用)。经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2,因此装置A的不足之处是⑨。 
下图装置可以完成多个实验,具有药品用量少、现象明显、尾气不外逸等优点。
⑴ 若滴管甲中吸有浓氨水,滴管乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无色酚酞溶液变红,主要说明分子具有的什么性质。
⑵ 若滴管甲中吸有水,滴管乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色的干燥纸花,烧杯②中盛有碳酸钠粉末。依次将甲、乙中的液体滴入烧杯①、②中,可观察的现象是什么?
⑶ 若滴管甲中的液体是水,且挤出后观察出气球明显鼓起,一段时间后恢复原状,则烧杯中的固体可能是什么物质?;若该现象是由发生化合反应而引起的,则该反应的化学方程式是。
某小型火力发电厂(以煤为燃料)排放大量的废气,对周围的空气产生了严重污染,并导致当地常降酸雨。为探究废气的成分,实验中学化学课外活动小组的同学将收集来的气体样品用如下装置进行实验。已知装置的连接顺序是丙→甲→乙,且其中的药品均足量。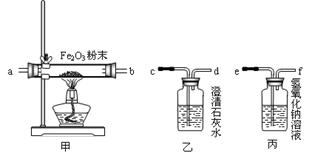
【猜想与假设】
A同学认为:废气中一定含有CO2
B同学认为:废气中可能含有CO
C同学认为:废气中可能含有SO2
【交流与评价】经过讨论,大家一致认为:电厂的燃煤中含有较多的硫元素或氮元素。请说明他们得出该结论的依据是。
【活动探究】在用上述装置进行的实验中,B同学的观点得到证实:废气中确实含有CO。那么丙装置的作用是什么?写出甲装置的玻璃管中反应的化学方程式。
探究燃烧条件的实验装置如图所示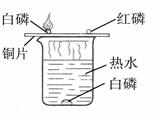
(1)由该实验得出,可燃物燃烧的另外两个条件是:、
(2)实验中使用了铜片,主要是利用铜的什么性质?
某化学兴趣小组用石灰石和盐酸反应制取CO2,并验证CO2的性质。在确认装置气密性良好后进行实验。把制得的气体通入澄清石灰水中,发现石灰水没有变浑浊。对此展开探究:
(1)【提出问题】澄清石灰水为什么没有变浑浊?
(2)【猜想与验证】
①甲同学认为可能石灰水已变质。他取少量澄清石灰水于试管中,向其中吹气,现象是__________,说明澄清石灰水没有变质。写出该反应的化学方程式。
②乙同学认为制得的CO2中可能混有HCl 。他作出此猜想的依据是__________
他用试管取少量紫色石蕊试液,再通入制得的气体,紫色石蕊试液变红,他得出结论是CO2中混有HCl 气体。
③ 丙同学认为乙同学的实验结论是错误的,理由是________________________
请你和他们一起设计实验证明:
| 实验步骤 |
实验现象 |
实验结论 |
| 用试管取少量AgNO3和稀HNO3的混合溶液,通入制得的气体 |
CO2中混有HCl 气体。 化学方程式 |
(3)【反思与评价】丁同学认为既然用盐酸会使制得的CO2不纯,何不用稀H2SO4代替盐酸。请问丁同学的想法对吗?_____,理由是__________________________