某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子 ,现进行如下实
,现进行如下实 验:
验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶 液中肯定存在的离子是__________ _______,肯定不存在的离子是________ _____。
液中肯定存在的离子是__________ _______,肯定不存在的离子是________ _____。
(2)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl-?______________。
(3)按照反应顺序 逐步书写出②中发生反应的离子反应方程式
逐步书写出②中发生反应的离子反应方程式
① H++OH-=H2O ②_____________ _____
③________ __________ ④ HCO3-+H+=H2O+CO2↑
⑤___________ _______
某课外兴趣小组对H2O2的分解速率做了如下实验探究。下表是该小组研究影响过氧化氢分解速率的因素时采集的一组数据:用10 mL H2O2制取150 mL O2所需的时间(秒)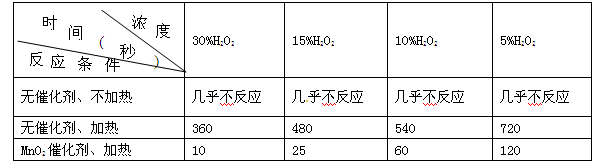
(1)该研究小组在设计方案时,考虑了浓度、____________、____________等因素对过氧化氢分解速率的影响;
(2)若已知1 克液态过氧化氢分解成氧气和液态水时,可放出2.89 kJ能量,写出该反应的热化学方程式:____________________;
(3)产生的O2充入某密闭容器,发生4NH3(g)+5O2(g) 4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________
4NO(g)+6H2O(g),不同情况测得反应速率,其中反应速率最快的是_________
| A.υ(NH3)="0.4" mol / (L·s) |
| B.υ(O2)="0.5" mol / (L·s) |
| C.υ(NO)="0.6" mol / (L·s) |
| D.υ(H2O)="1" mol / (L·min) |
A、B、C、D、E、F是原子序数小于20的四种元素,已知A元素+1价的阳离子与C的阳离子具有相同的电子层结构,B元素最高正价的绝对值与负价的绝对值之差等于6。1molC单质与足量的稀硫酸反应可生成1.5molH2,反应后C元素原子形成的离子和氖原子的电子层结构相同。以D元素为核心可以形成种类最多的一类化合物。E的单质是密度最小的物质。F原子的最外层电子数是核外电子总数的 ;
;
(1)写出A、C两元素最高价氧化物的水化物间反应的离子方程式___________________________;
(2)比较B与C元素形成离子的半径:B元素形成的离子半径______C元素形成的离子半径(填“>”、“=”或“<”)
(3)D与F形成的一种化合物是参与大气循环的气体,写出它的电子式________________;
在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1∶1或2∶1形成化合物,但常温时A、B形成的化合物呈液态,C、B形成的化合物呈固态,D的原子最外层电子数最多,E的核电荷数最大,D与E组成的ED4常温下为气态。
(1)画出D的原子结构示意图____,五种元素原子半径从大到小的顺序是____ (填元素符号);
(2)写出A与B可以形成2种化合物的结构式为____,____;
(3)由C与B原子形成的2种化合物的电子式分别是____、____;
(4)D、E所形成氢化物的稳定性由强到弱的顺序是____ (填具体的化学式);
(5)由短周期元素组成的某些微粒,原子总数相同、价电子总数相同的分子(或离子)如SO2、O3、NO,可互称为等电子体,则与B、D同周期元素组成的微粒中,能与N、CS2互称为等电子体的微粒是____,____ (填符合要求2种微粒的名称);
(6)写出工业上制E单质的化学方程式: ____。
有X、Y、Z、M 、N按原子序数依次递增的五种短周期元素,其中Z、M、N同周期,X、Z同主族且X是原子半径最小的原子;Y、N同主族,Z+与Y2—具有相同的电子层结构;M的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)M的元素名称,N在元素周期表中的位置。
(2)离子半径比较:r(Z+)r(Y2—)。
(3)X与Z形成的化合物A是(填“离子化合物”或“共价化合物”),A与X2Y反应的化学方程式是。
某原子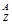 X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
X,它的氯化物XCl 7.45g溶于水制成溶液后, 加入2 mol·L━1的AgNO3溶液50mL恰好完全反应,若这种原子原子核内有20个中子,求:
(1)Z值=和A=值;
(2)X元素在周期表中的位置第周期族。