现有一盛有无色固体物质M的试剂瓶,标签已破损(见图)。已知硫酸、盐酸、硝酸等是强酸,碳酸、氢硫酸、亚硫酸、醋酸等是弱酸,烧碱、苛性钾等是强碱,一水合氨等是弱碱。由强酸与强碱组成的正盐呈中性,由强酸弱碱组成的正盐呈酸性,由弱酸强碱组成的正盐呈碱性。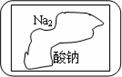
(1)若M的水溶液为中性,则实验室检验M中阴离子的离子方程式为_____________________________________。
(2)若M的水溶液呈碱性,加入过量盐酸后产生无色无味的气体,则产生的气体的化学式为_______________。
(3)若M置于空气中易被氧化为另一种物质,生成物的摩尔质量比M增加了16,则M的化学式为_______________。
(4)若M的水溶液呈碱性,加入过量盐酸后产生腐卵臭气味的气体,则M与盐酸反应后生成的气体在过量空气中燃烧的化学方程式为________________________。
抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。
(1)抗酸药物具有抗酸作用的原因是______________________________________________。
(2)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
①写出该抗酸药发挥功效时的离子方程式:______________________________、______________________________。
②淀粉在抗酸药中作填充剂、黏合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写结构简式)______________________________。
我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO 3 ),据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一__________。
A.胰岛素 B.甲状腺激素
C.生长激素D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患___________。
A.甲状腺亢进B.贫血症
C.地方性甲状腺肿D.糖尿病
(3)可用盐酸酸化的碘化钾淀粉溶液,检查食盐中是否含碘酸钾。反应的化学方程式为
5KI+KIO 3 +6HCl="===6KCl+3I" 2 +3H 2 O。
此反应的氧化剂是__________(填化学式),可观察到的现象是__________。
下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品名 |
××× |
| 配料 |
鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、碳酸氢钠、柠檬酸、柠檬汁、食盐、甜蜜素、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 保质期 |
240天 |
| 生产日期 |
标于包装袋封口上 |
(1)富含蛋白质的是__________;
(2)富含糖类的是__________;
(3)富含油脂的是__________;
(4)富含维生素的是__________;
(5)属于着色剂的有__________;
(6)属于调味剂的有__________;
(7)属于防腐剂的有__________;
(8)属于疏松剂的有__________。
大麻酚及它的衍生物都属麻醉药品,并且毒性较强。吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中。吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高。大麻酚分子结构为
回答下列问题: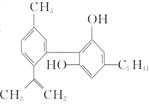
(1)大麻酚的分子式为__________。
(2)写出大麻酚燃烧的化学方程式:______________________________________________。
(3)大麻酚属酚类化合物,写出大麻酚与NaOH及足量溴水的反应产物__________。
感冒是一种常见的病,人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些治疗感冒的药,可以舒缓症状,减轻病情。
(1)药物阿司匹林是一种传统的治疗感冒发烧的老药,从分子结构上看,它可以看作是乙酸酯,其结构简式如下图: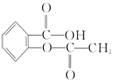
作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成_________和_________(用结构简式表示),阿司匹林分子水解后,能电离出氢离子(H + )的官能团增多,增大了对胃肠道的刺激。
(2)为减小副作用,一般宜饭后服药,并同时服用少量辅助药物,在①硫酸镁、②氢氧化钡、③碳酸钙中选取哪一种?