(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化 学方程式。
学方程式。
________ + ________ → ________ + ________ + ________ + H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1mol氧化剂_______(填“得到”或“失去”)________mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中: __________+
__________+ __________→
__________→
重要的精细化学晶M和N,常用作交联剂、涂料、杀虫剂等,合成路线如下图所示: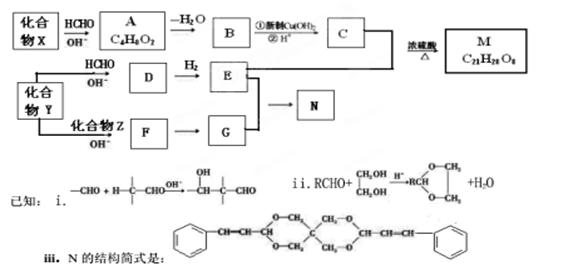
请回答下列问题:
(1)A中氧官能团的名称为__________________.由A生成B的反应类型为________________
(2)X的结构简式为______________________
(3)由B生成C的反应①的化学方程式为______________________
(4)C和甲醇反应的产物可以聚合形成有机玻璃,该聚合反应的化学方程式为___________
(5)E的结构简式为_______________,E的同分异构体有多种,其中与E具有相同官能团的同分异构体有_____________种(提示:同一碳原子上连有两个或以上羟基是不稳定的,)试写出其中一种的结构简式______________.
(6)下列说法正确的是()
| A.E能发生消去反应 | B.1mol M中含有4mol 酯基 |
| C.X与Y是同系物 | D.1mol G与足量H2加成可消耗2mol H2 |
(7)由Y生成D的化学方程式为_________________________
(8)Z的结构简式为___________________________.
(9)由F生成G的化学方程式为__________________________.
有关物质间有下图所示的转化关系。已知B、D、G是常见的金属单质,E为常见非金属单质,H常温下为无色液体,K为红棕色气体。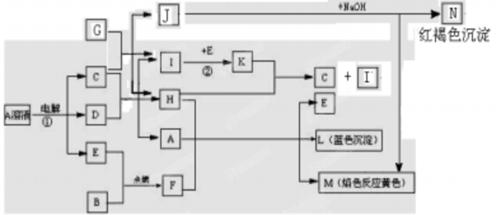
(1)F的电子式_____________,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目_____________________________________
(2)反应①的离子方程式_________________________________________.
(3)C与足量G反应的化学方程式_______________________________,其中,还原剂与氧化剂的物质的量之比______________________,检验反应中生成金属离子的方程式__________________________________
(4)Al能与A发生置换反应,生成物溶质与Na2CO3不能在溶液中共存,用离子方程式表示其原因:___________________________
(5)I可由某种氢化物催化氧化得到,其化学反应方程式为________________________
(6)漂白粉同F都应密封保存,写出漂白粉露置于空气中失效的化学反应方程式______________________、__________________________________。
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验: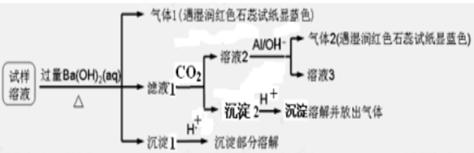
已知:3NO3-+8Al+5OH-+2H2O 3NH3+8AlO2-
3NH3+8AlO2-
根据以上的实验操作与现象对下列说法进行判断:
(1)试样中肯定存在的离子是_________________________
(2)沉淀1的成分为_______________________________
(3)下列说法正确的是()
| A.该雾霾中可能存在NaNO3、NH4Cl、MgSO4 |
| B.试样中一定不含Al3+ |
| C.PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物,PM2.5分散在空气中形成的混合物属于胶体 |
| D.大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
(4)Al3+可以与碱反应生成Al(OH)3沉淀,写出实验室制取Al(OH)3的离子方程式:_____________________。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)从开始至2min,Z的平均反应速率为
已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和碘反应生成1 mol HI需要(填“放出”或“吸收”)k J的热量。