欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。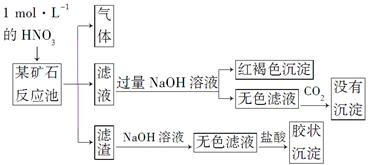
(1)Si在周期表中的位置是___________________________________。
(2)下列说法正确的是________。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是________,滤渣和NaOH溶液反应的离子方程式是_________________________________________________________。
(4)该矿石和1 mol·L-1HNO3反应的离子方程式为
___________________________________________________________。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中。目的是____________________________________;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol·L-1 HNO3的体积为________L。
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。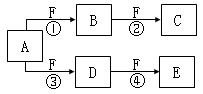
回答下列问题:
(1)A的电子式为______________。
(2)A和E反应生成G,C与G中都含有_______________(填化学键的类型)。(3)反应③中如果转移的电子为3 mol,则被氧化的A为__________mol。
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式:_____________________________________________________。
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO4-形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:___________________________________________________________________。
(共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______________(填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶物 |
| 质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。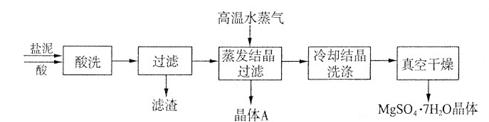
回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因_________。
②过滤所得滤渣的主要成分为____________________________。
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为____________________。
④真空干燥MgSO4·7H2O晶体的原因是______________________。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol/L。
(共17分)本题分三个部分,分别完成以下问题:
I.下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60)②CH3CH2CH2CH(C2H5)CH3和 CH3CH2CH2CH(CH3)C2H5
③235U、238U④氧气(O2)与臭氧(O3) ⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑥淀粉和纤维素 ⑦
(1)是同素异形体的是______________,(填序号,下同)(2)是同位素的是___________,
(3)是同分异构体的是___________,(4)是同一物质的是___________。
II.下列物质:①Cl2②Na2O2③NaOH ④HCl ⑤C2H6⑥MgF2⑦HNO3
(1)只由离子键构成的物质是______________(填序号,下同)
(2)由离子键和非极性键构成的物质是______________
(3)由极性键和非极性键构成的物质是______________
III.提纯下列物质(括号内的物质是杂质),请将所选用的除杂试剂和分离方法(填字母或者序号)填入对应的空格中(若不选,填“无”)
除杂试剂:
| A.盐酸 | B.酸性高锰酸钾 | C.氢氧化钠溶液 | D.(浓)溴水 |
E. H2(催化剂) F. CaO G. NaCl
分离方法:① 蒸馏② 分液③ 洗气④ 过滤
| 被提纯的物质 |
除杂试剂 |
分离方法 |
|
| (1) |
酒精(水) |
||
| (2) |
乙烷(乙烯) |
||
| (3) |
硬脂酸钠溶液(甘油) |
||
| (4) |
苯(苯酚) |
||
| (5) |
SiO2(Al2O3) |
如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的9/ 10,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)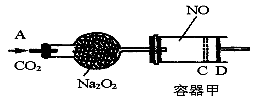
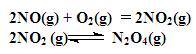
已知: 2Na2O2 + 2CO2= 2Na2CO3 + O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。
①此时,通入标准状况下的CO2气体L ,容器甲中NO2转化为N2O4的转化率是
②活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必0.01(填大于、小于、等于),其理由是
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于________g。
(1)将100克质量分数为10%的NaOH溶液与50克质量分数为20%的NaOH溶液混合后,加水稀释至溶液体积为500ml,则稀释后NaOH的物质的量浓度为
(2)有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+ 完全沉淀;另一份滴加AgNO3溶液,使Cl— 完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为mol·L-1
(3)某化合物质X,受热分解3X=A+2B+3C,产物均为气体,测得生成物混合气体对相同条件下氢气的相对密度为22 ,则X的相对原子质量为
(4)标准状况下,将15 LO2通入10LH2和CO的混合气中,充分燃烧干燥后,恢复至标准状况
①若剩余的气体体积为15 L,则原混合气中V(CO)=
②若剩余的气体体积为a L,则原混合气中V(CO) : V(H2)=