(共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______________(填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶物 |
| 质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。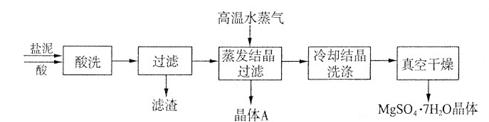
回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因_________。
②过滤所得滤渣的主要成分为____________________________。
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为____________________。
④真空干燥MgSO4·7H2O晶体的原因是______________________。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol/L。
空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ: 目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。
(1)前3min内,平均反应速率v(H2)= mol·L-1·min-1。此温度下该反应的平衡常数为 (保留两位小数,注意要写单位)。
(2)下列措施中,既能使反应加快,又能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入惰性气体
C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的条件是 。(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化学平衡 (填“正向”、“逆向”或“不”)移动。
Ⅱ:利用CO2(g)+CH4(g) 2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
(5)下列事实能说明该反应达到平衡的是( )
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)= 2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是 。
(7)若将上述容器改为恒压容器(反应前体积相同),起始时通入物质的量均为0.1 mol的CH4与CO2,相同的温度下充分反应达到平衡后,放出热量Q2 kJ,
则Q1 Q2(填 “>”“=”或“<”)
Ⅲ: 设反应①Fe(s)+CO2(g) FeO(s)+CO(g) 和反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 和反应②Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
| T(K) |
K1 |
K2 |
| 973 |
1.47 |
2.36 |
| 1173 |
2.15 |
1.67 |
(8)现有反应CO2(g)+H2(g) CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜。

(1)甲池中盛有CuSO4溶液,反应一段时间后,有红色物质析出的是 棒,甲池中铁电极上电极反应式是 。
(2)乙池中盛有饱和NaCl溶液,总反应的化学方程式为 。若往乙池中滴入酚酞试液, 电极(填“Fe”或“C”)附近呈现红色。反应一段时间后,若要使溶液恢复到电解前的状态,可以向溶液中通入一定量的 。
(3)丙池中粗铜电极发生 (填“氧化”或“还原”)反应,反应过程中,Cu2+的浓度 (填“增大”、“减小”或“不变”)。
A、B、C和D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种.现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定(已知铝盐与过量的NaOH溶液反应没有白色沉淀).回答下列问题。
(1)试确定A、B各代表何种溶液(用化学式回答)。A: B:
(2)写出下列反应的离子方程式:
X与过量的C反应生成白色沉淀Ⅱ:
白色沉淀Ⅰ与D反应: 。
已知以下两个氧化还原反应的化学方程式:
①4HCl(浓)+MnO2  Cl2↑+MnCl2+2H2O②KClO3+6HCl(浓)
Cl2↑+MnCl2+2H2O②KClO3+6HCl(浓) 3Cl2↑+KCl+3H2O
3Cl2↑+KCl+3H2O
(1)用双线桥法表示反应②中的电子转移情况: 。
(2)若反应②中生成标准状况下6.72L的Cl2,则被氧化的HCl的物质的量是__________。
(3)将反应①改写成离子方程式: 。
(4)①和②中生成等量的Cl2转移的电子的物质的量之比为 。
(1)下列物质中,物质的量最大的是________,含原子个数最多的是________,质量最大的是________。
A 6 g H2; B 0.5 mol CO2; C 1.204×1024个HCl分子;
D 147 g H2SO4; E 92 g乙醇(C2H5OH); F 4 ℃时10 mL水
(2)在标准状况下,测得1.32 g某气体的体积为0.672 L。则此气体的摩尔质量为 。
(3)8gNaOH溶于 g水中,才能使每10个水分子中溶有一个钠离子。