(共17分)本题分三个部分,分别完成以下问题:
I.下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60) ②CH3CH2CH2CH(C2H5)CH3和 CH3CH2CH2CH(CH3)C2H5
③235U、238U ④氧气(O2)与臭氧(O3) ⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑥淀粉和纤维素 ⑦
(1)是同素异形体的是______________,(填序号,下同)(2)是同位素的是___________,
(3)是同分异构体的是___________, (4)是同一物质的是___________。
II.下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤C2H6 ⑥MgF2 ⑦HNO3
(1)只由离子键构成的物质是______________(填序号,下同)
(2)由离子键和非极性键构成的物质是______________
(3)由极性键和非极性键构成的物质是______________
III.提纯下列物质(括号内的物质是杂质),请将所选用的除杂试剂和分离方法(填字母或者序号)填入对应的空格中(若不选,填“无”)
除杂试剂:
| A.盐酸 | B.酸性高锰酸钾 | C.氢氧化钠溶液 | D.(浓)溴水 |
E. H2(催化剂) F. CaO G. NaCl
分离方法:① 蒸馏 ② 分液 ③ 洗气 ④ 过滤
| |
被提纯的物质 |
除杂试剂 |
分离方法 |
| (1) |
酒精(水) |
|
|
| (2) |
乙烷(乙烯) |
|
|
| (3) |
硬脂酸钠溶液(甘油) |
|
|
| (4) |
苯(苯酚) |
|
|
| (5) |
SiO2(Al2O3) |
|
|
下列各物质:①O2、O3②H2、D2、T2③12C、14C
④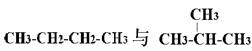 ⑤
⑤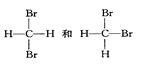
互为同分异构体的是(填序号,下同);互为同位素的是
互为同素异形体的是;是同一种分子的是
在2
密闭容器内,800 ℃时反应:
 ,
体系中,
随时间的变化如表:
,
体系中,
随时间的变化如表:
| 时间(
) |
0 |
1 |
2 |
3 |
4 |
5 |
| 0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)用
表示从0~2
内该反应的平均速率
。 (2)右图中表示
浓度的变化的曲线是。
(2)右图中表示
浓度的变化的曲线是。
(3)能说明该反应已达到平衡状态的是。
A.
B.容器内压强保持不变
C.
逆
=2
正
D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
A.及时分离除
气体B.适当升高温度
C.增大
的浓度D.选择高效催化剂
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
(1)已知常温时32g甲烷燃烧放出的热量为akg,写出甲烷标准燃烧热的热化学方程式;
(2)以甲烷为燃料和KOH溶液为电解质制成燃料电池。
其电池负极反应式是:;
其电池总反应化学方程式是:。
已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(1)25时,将=9的NaOH溶液与=4的溶液混合,混合所得溶液的=7,则NaOH溶液与溶液的体积比为
(2)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是
(3)95时,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5 ,则HA是(填“强酸”或“弱酸”)