(1)某化学反应可用下式表示:A + B ="=" C + D + H2O ,若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,
写出该反应的离子方程式:
(2)硝酸铅的稀溶液中,滴入几滴稀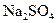 生成白色
生成白色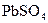 沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式
沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式
① ②
(3)边微热边向铵明矾[NH4Al(SO4)2`12H2O]溶液中逐滴加入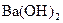 溶液至中性
溶液至中性
(提示:NH+ 4 、Al3+恰好完全反应)
①此时发生反应的离子方程式为
②向以上所得中性溶液中继续滴加稀硫酸,相关反应的离子方程式是:
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如图。
(1)加MgO后过滤所得滤渣的主要成分为。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?。
(3)加入NaClO3饱和溶液会发生如下反应:
MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应,②;③;④;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(4)上述产品测定中需要检查是否漏液的仪器有。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏。(填“大”或“小”)。
(5)产品中Mg(ClO3)2·6H2O的质量分数为。(计算结果保留两位小数)
某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH="12.3" [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体, 减小
减小
d.稀释溶液,平衡常数增大
在一百多种化学元素中,非金属占了23种。80%的非金属元素在社会中占重要位置。如C、N、O、Si、Cl等。
(1)氯元素原子最外电子层上有种能量不同的电子,该元素的简单阴离子核外电子排布式是。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于晶体,请写出该化合物的化学式。
(3)下列事实能说明氯与氧两元素非金属性相对强弱的有。(选填编号)
a.Cl原子最外层电子数比氧多
b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为−2价
d.沸点:H2O>HCl
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2 +HCl ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)
(4)上述方程式中,缺项物质是___________,配平方程式,并在下面补全反应物系数。____NaClO2 +____HCl
(5)该反应中氧化剂和还原剂的物质的量之比是。生成0.2 mol ClO2转移电子的物质的量为_______ mol。
(6)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN-a mg/L,现用ClO2将CN-氧化,只生成两种无毒气体。处理100m3这种污水,至少需要ClO2 _______ mol 。
可用呋喃为主要原料合成聚酰胺纤维(尼龙-66,含有-CO-NH-结构),合成路线如下:

回答下列问题:
(1)写出反应类型:反应③________________;反应⑥________________。
(2)写出A、B的结构筒式:
A________________________________;B________________________________。
(3)写出有关的化学方程式:
反应②________________________________________________________________
反应⑥________________________________________________________________
(4)呋喃与苯相似,也具有芳香性,则可推知呋喃能发生的化学反应是__________ (选填编号)。
a.使溴水褪色 b.使酸性高锰酸钾溶液褪色 c.与溴发生取代反应 d.发生l,4加成反应
(5)写出乙酰胺制取乙腈(CH3C≡N)的化学方程式:_______________________________。
(6)H是A的同分异构体,被酸性高锰酸钾溶液氧化生成丙二酸和CO2,则H的结构简式为___________。
苯是重要的化工原料,请回答以下制备中的有关问题:


(1)指出反应类型。反应①是氧化反应,反应③是____________。
(2)写出结构简式:B_____________________;D____________________。
(3)不能由 直接制取
直接制取 ,理由是__________________________;C生成D时还可能生成另一种有机物,分离D和该有机物的方法是______________________。
,理由是__________________________;C生成D时还可能生成另一种有机物,分离D和该有机物的方法是______________________。
(4)检验A是否全部转化为B可用的试剂是______________________。
(5)将F与浓硫酸共热,生成的有机物可能_________种。